การสังเกตตัวอย่างทางชีวภาพโดย JEM-1400Flash ー การไหลจากการเตรียมตัวอย่างไปจนถึงการสังเกต ー
EM2021-01
บทนำ
การใช้กล้องจุลทรรศน์อิเล็กตรอนช่วยให้สามารถสังเกตโครงสร้างจุลภาคในเซลล์ซึ่งไม่สามารถทำได้ด้วยกล้องจุลทรรศน์แบบใช้แสง เพื่อให้เข้าใจโครงสร้างโดยละเอียดของออร์แกเนลล์ เช่น ไมโทคอนเดรียและคลอโรพลาสต์ กล้องจุลทรรศน์อิเล็กตรอนเป็นเครื่องมือที่ทรงพลัง อย่างไรก็ตาม ด้วย TEM การสังเกตของชิ้นงานทดสอบในสภาพมีชีวิตเป็นไปไม่ได้เนื่องจากการสังเกตจะดำเนินการในสุญญากาศ นอกจากนี้ ในการที่จะส่งลำอิเล็กตรอนได้ ชิ้นงานจะต้องถูกหั่นเป็นชิ้นบางๆ
เพื่อจุดประสงค์นี้ การเตรียมชิ้นงานทดสอบเป็นขั้นตอนที่สำคัญมากในการจับโครงสร้างของชิ้นงานโดยไม่มีสิ่งปลอมปน บันทึกการใช้งานนี้อธิบายการไหลของการเตรียมตัวอย่างสำหรับตัวอย่างทางชีวภาพ โดยใช้ตัวอย่างเนื้อเยื่อพืชเพื่อแนะนำข้อมูลที่ได้รับจาก JEM-1400Flash
การไหลของการเตรียมตัวอย่าง
มีหลายวิธีในการเตรียมตัวอย่างทางชีวภาพ ตัวอย่างเช่น เราได้แนะนำการตรึงชิ้นงานทดสอบโดยใช้วิธีการตรึงทางเคมีและวิธีการตัดเฉือนแบบบางเฉียบโดยใช้อุลตร้าไมโครโครโตม ขั้นตอนการเตรียมชิ้นงานทดสอบเป็นไปตามลำดับดังนี้ 1. การตัดชิ้นงานทดสอบ 2. การตรึง 3. การคายน้ำ 4. การทดแทน 5. การฝัง 6. การโพลิเมอไรเซชัน 7. การตัดแต่ง 8. การแบ่งส่วนแบบบางเฉียบ 9. การย้อมสี แต่ละขั้นตอนมีการอธิบายไว้ด้านล่าง
1. การตัดตัวอย่าง
ชิ้นงานทดสอบถูกตัดเป็นชิ้นเล็กๆ โดยใช้ใบมีดโกน เพื่อให้สารเคมีที่ใช้ในกระบวนการผลิตต่อไปซึมผ่านได้ง่าย
2. การตรึง
กระบวนการหยุดการเปลี่ยนแปลงโครงสร้างของตัวอย่างทางชีวภาพด้วยสิ่งประดิษฐ์เพียงไม่กี่ชิ้น สำหรับการตรึงด้วยสารเคมี การตรึงจะดำเนินการสองครั้ง: การตรึงล่วงหน้าและการตรึงภายหลัง คำนำหน้าใช้เพื่อตรึงโปรตีน และใช้หลังการตรึงเพื่อแก้ไขไขมัน
หมายเหตุ: Osmium tetroxide มีความผันผวนและมีปฏิกิริยาสูง และสามารถทำลายระบบทางเดินหายใจ ผิวหนัง และเยื่อเมือกของผู้ใช้ได้ ดังนั้น กระบวนการนี้ควรทำในอาหารที่มีควัน
รีเอเจนต์
- สารละลายนำหน้า:กลูตาราลดีไฮด์ 2.5 % และพาราฟอร์มัลดีไฮด์ 2% ใน 0.1 M HEPES*¹ (ครึ่งคาร์นอฟสกี)
- สารละลายหลังการตรึง:สารละลายออสเมียมเตตรอกไซด์ 1 % (OsO4 ใน 0.1 M HEPES)
- น้ำยาล้าง:0.1 M HEPES หรือน้ำกลั่น
- ขวดตัวอย่าง
*1 HEPES: ตัวย่อของสารละลายบัฟเฟอร์ 2- [4- (2-Hydroxyethyl) -1-piperazinyl] ethanesulfonic acid
3. การคายน้ำ
ใช้เอทานอลหรืออะซิโตนเพื่อทำให้ปริมาณน้ำในเซลล์ขาดน้ำ หากความชื้นยังคงอยู่ ปริมาณน้ำที่เหลืออยู่จะป้องกันไม่ให้เกิดพอลิเมอไรเซชันของเรซินในระหว่างการฝังเรซินในภายหลัง ปฏิบัติตามกระแสด้านล่างเพื่อแช่ตัวอย่างในความเข้มข้นของเอทานอลแต่ละชนิดเพื่อทดแทนปริมาณน้ำด้วยเอทานอล

4. การทดแทน
เมื่อถูกทำให้แห้งด้วยเอทานอล จะถูกแทนที่ด้วยโพรพิลีนออกไซด์ (PO) หรือคล้ายกันในฐานะสารตัวกลางเพื่อผสมกับอีพอกซีเรซิน
รีเอเจนต์
- PO
- อีพอกซีเรซิน
※ EPON 812 . ของ TAAB*2 ถูกนำมาใช้
- PO เท่านั้น 2x5 นาที
- PO:เรซิ่น=2:1 2 ชั่วโมง
- PO:เรซิ่น=1:1 2 ชั่วโมง
- PO:เรซิ่น=1:2 2 ชั่วโมง
- เรซิ่นเพียง 18 ถึง 24 ชั่วโมง
- การปรับเรซิน -
- วัด EPON 812*2, ดีดีเอสเอ*3, สพม*4 ตามสัดส่วนที่แสดงในตารางแล้วใส่ลงในบีกเกอร์
- คนให้เข้ากันโดยใช้เครื่องกวน
- เพิ่ม DMP-30*5 และกวน
- ขจัดแก๊สเรซินและขจัดฟองอากาศ
ตาราง: การผสมอีพอกซีเรซิน
| (%) | อ่อนนุ่ม | กลาง | ยาก |
|---|---|---|---|
| EPON812 | 48 | 48 | 48 |
| ดีดีเอสเอ | 30 | 19 | 12 |
| MNA | 20 | 33 | 40 |
| ดีเอ็มพี-30 | 2 | 2 | 2 |
ข้อมูลอ้างอิง:เอกสารข้อมูลของ TAAB 12a
*2 EPON 812:เรซิน, *3 ดีดีเอสเอ・*4 MNA: ตัวชุบแข็ง, *5 DMP-30:สารเร่งความเร็ว
5. การฝัง
เพื่อเตรียมชิ้นส่วนที่บางเป็นพิเศษ จำเป็นต้องฝังชิ้นงานทดสอบในสารฝังแข็ง เช่น เรซิน
เรซินเหลวจะบ่มในระหว่างกระบวนการโพลิเมอไรเซชันในภายหลัง
เครื่องมือ
- อีพอกซีเรซิน
- แผ่นฝังซิลิโคน (รูปที่ 1)
- เทเรซิน
- วางชิ้นงานทดสอบไว้ที่ปลายแผ่นซิลิโคนฝังตัว
- ปล่อยให้นั่งสักครู่เพื่อผสมผสาน

รูปที่ 1 แผ่นฝังซิลิโคน
6. พอลิเมอไรเซชัน
อุ่นเรซินเพื่อรักษา เพื่อให้สามารถหั่นเรซินบางๆ ได้ วางแผ่นซิลิโคนฝังลงในเตาอบและเก็บไว้ที่อุณหภูมิ 60°C เป็นเวลาสามวัน การทำให้อุณหภูมิคงที่ในระหว่างการทำโพลิเมอไรเซชันสามารถป้องกันความล้มเหลวของโพลิเมอไรเซชันของเรซินได้
เครื่องมือ
- เตาอบสำหรับเรซินพอลิเมอไรเซชัน
7. การตัดแต่ง
ตัดชิ้นงานทดสอบภายใต้กล้องจุลทรรศน์แบบออปติคัลเพื่อให้พื้นที่ที่จะสังเกตมีขนาดที่จะวางบนกริดของชิ้นงานทดสอบและกำหนดรูปร่างของพื้นผิวที่จะสังเกต
เครื่องมือ
- ใบมีดโกน
- กล้องจุลทรรศน์ออปติคอล
8. การแบ่งส่วนบางเฉียบ
นำเรซินออกเพื่อให้เห็นพื้นผิวของเนื้อเยื่อโดยใช้มีดแก้ว จากนั้นหั่นเป็นชิ้นบางพอที่จะส่งลำแสงอิเล็กตรอนด้วยมีดเพชรและ ultramicrotome แล้ววางบนตะแกรง
เครื่องมือ
- อัลตร้าไมโครโตม
- ตะแกรง
- มีดเพชร
- มีดแก้ว
- โพรบขนตา(รูปที่. 2)

รูปที่ 2 โพรบขนตา
9. การย้อมสี
การดำเนินการนี้ใช้เพื่อเพิ่มความคมชัดของตัวอย่างทางชีวภาพซึ่งมีธาตุแสงจำนวนมาก ความคมชัดของการกระเจิงเพิ่มขึ้นโดยการผูกองค์ประกอบหนักเข้ากับชิ้นงานทดสอบ เมื่อทำการย้อมส่วนที่บางเฉียบบนตะแกรง การย้อมสีสองครั้งจะดำเนินการโดยใช้ยูแรนิลอะซิเตตและตะกั่วซิเตรตเป็นสารย้อมสี Uranyl acetate คราบนิวคลีโอพลาสซึมและไรโบโซม ในขณะที่ตะกั่วซิเตรตเปื้อนเยื่อหุ้มเซลล์ เม็ดไกลโคเจน และไรโบโซม
รีเอเจนต์
- ยูเรนิลอะซิเตท*6
- ตะกั่วซิเตรต
*6 Uranyl acetate เป็นสารประกอบซึ่งเป็นสารควบคุมระดับสากลที่สามารถใช้ได้ในโรงงานที่ได้รับอนุญาตเท่านั้น
สารละลายทางเลือกสำหรับยูแรนิลอะซิเตต ได้แก่ อิตเทอร์เบียมอะซิเตท
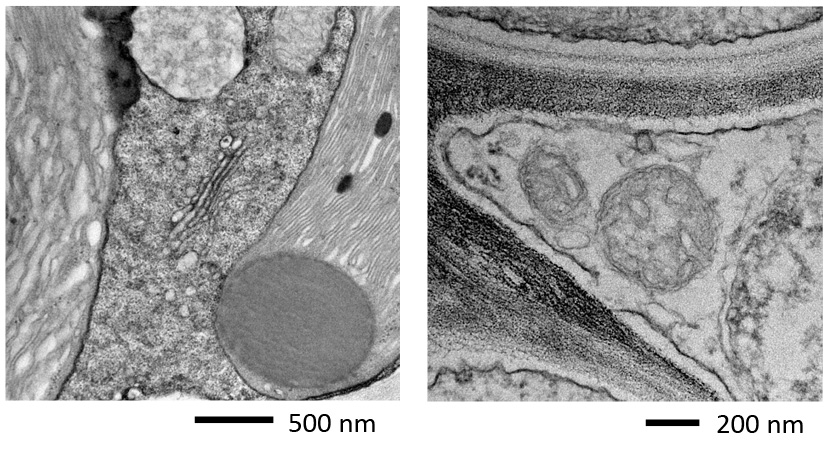
ผล
รูปที่ 3 แสดงผลการสังเกตชิ้นงานแบบบางเฉียบที่เตรียมโดยปฏิบัติตามขั้นตอนข้างต้น โดยใช้ TEM (JEM-1400Flash)
- โปรดดูไฟล์ PDF สำหรับข้อมูลเพิ่มเติม
หน้าต่างอื่นจะเปิดขึ้นเมื่อคุณคลิก 
PDF1.2MB
สินค้าที่เกี่ยวข้อง
คุณเป็นผู้เชี่ยวชาญทางการแพทย์หรือบุคลากรที่เกี่ยวข้องกับการรักษาพยาบาลหรือไม่?
ไม่
โปรดทราบว่าหน้าเหล่านี้ไม่ได้มีวัตถุประสงค์เพื่อให้ข้อมูลเกี่ยวกับผลิตภัณฑ์แก่ประชาชนทั่วไป