การวิเคราะห์ตัวชี้วัดทางชีวภาพในตัวอย่างปิโตรเลียมโดยใช้ GC×GC-HRTOFMS พร้อมด้วยแหล่งกำเนิดไอออนที่รวมอิเลคตรอนไอออไนเซชัน (EI) และไอออไนเซชันด้วยแสง (PI) [แอปพลิเคชัน GC-TOFMS]
JEOL NEWS ฉบับที่ 53 No.9
Masaaki Ubukata และ Yoshihisa Ueda
หน่วยธุรกิจ MS, JEOL Ltd.
ตัวอย่างปิโตรเลียมสองประเภทได้รับการวิเคราะห์โดย "JMS-T200GC AccuTOFTM GCx-plus" ซึ่งเป็นรุ่นล่าสุดของ JEOL GC-TOFMS (แมสสเปกโตรมิเตอร์แก๊สโครมาโตกราฟี time-of-flight) ที่มีความละเอียดมวลสูงและความสามารถในการรับมวลสารด้วยความเร็วสูง รวมกับแหล่งกำเนิดแสงและระบบ GC×GC ไบโอมาร์คเกอร์หลายชนิด เช่น 18-Norabiotane, Cholestane, Hopane, Adamantane, Iceane และ Diamantane สามารถแยกและตรวจจับแบบเลือกโดย GC×GC และ photoionization
บทนำ
เป็นผลมาจากความก้าวหน้าล่าสุดในเทคโนโลยีแก๊สโครมาโตกราฟี (ต่อไปนี้จะเรียกว่า "GC") โดยเฉพาะอย่างยิ่งสำหรับเทคโนโลยีคอลัมน์ของเส้นเลือดฝอย คอลัมน์เส้นเลือดฝอยที่หลากหลายได้รับการพัฒนาด้วยความสามารถในการแยกที่แตกต่างกัน นอกจากนี้ GC แบบสองมิติที่ครอบคลุม (ต่อไปนี้จะเรียกว่า "GC×GC") ได้รับการพัฒนาโดยใช้ความสามารถของคอลัมน์เส้นเลือดฝอยเพื่อแยกสารเคมีที่มีองค์ประกอบที่ซับซ้อนมาก [1, 2] ระบบ GC×GC ประกอบด้วยคอลัมน์เส้นเลือดฝอยสองประเภทที่มีโหมดการแยกที่แตกต่างกันซึ่งเชื่อมต่อเป็นอนุกรม นอกจากนี้ ยังมีระบบดักจับความเย็น (ตัวปรับอุณหภูมิ) ที่วางอยู่ระหว่างคอลัมน์ที่หนึ่งและคอลัมน์ที่สองเพื่อปรับการฉีดตัวอย่างลงในคอลัมน์ที่สอง ระบบสองคอลัมน์นี้ช่วยให้ GC×GC ใช้โหมดการแยกสองโหมดที่แตกต่างกันในการวิเคราะห์ครั้งเดียว ส่วนประกอบจะถูกแยกจากกันในคอลัมน์แรก โดยดักจับด้วยความเย็นเป็นเวลา 5-10 วินาที จากนั้นจึงปล่อยอย่างรวดเร็วโดยตัวปรับความร้อนไปยังคอลัมน์ที่สองซึ่งมีเส้นผ่านศูนย์กลางภายในแคบและมีความยาวสั้น กระบวนการนี้หมายความว่าส่วนประกอบที่ถูกชะออกจากคอลัมน์แรกจะถูกดักจับและปล่อยในช่วงเวลา 5 ถึง 10 วินาที จากนั้นจะถูกแยกออกอย่างต่อเนื่องและรวดเร็วในคอลัมน์ที่สอง ด้วยเหตุนี้ โครมาโตแกรมสองมิติจึงมีแกนเวลาการยึดสองแกน แกนหนึ่งสำหรับคอลัมน์หลักและอีกแกนสำหรับคอลัมน์รอง
โดยทั่วไป แมสสเปกโตรมิเตอร์แบบควอดรูโพล (ต่อไปนี้จะเรียกว่า "QMS") ถูกนำมาใช้กันอย่างแพร่หลายสำหรับการวัดด้วย GC-MS อย่างไรก็ตาม ระบบเหล่านี้โดยทั่วไปไม่เหมาะที่จะเป็นเครื่องตรวจจับ GC×GC ตามที่อธิบายไว้ก่อนหน้านี้ คอลัมน์ที่สองของระบบ GC×GC มีรูปทรงที่เป็นเอกลักษณ์ (เส้นผ่านศูนย์กลางแคบและความยาวสั้น) ที่แยกส่วนประกอบออกอย่างรวดเร็ว คุณลักษณะนี้ส่งผลให้ความกว้างพีคที่แคบด้วยโครมาโตกราฟีซึ่งต้องการความเร็วในการรับข้อมูลสูง เพื่อให้ได้จุดข้อมูลเพียงพอในแต่ละพีคของการวิเคราะห์ หากใช้ QMS จะมีจุดข้อมูลที่จำกัดที่วัดสำหรับพีคมิติที่สองในโครมาโตแกรม ซึ่งส่งผลให้ข้อมูลโครมาโตกราฟี 2 มิติมีคุณภาพต่ำ ดังนั้นจึงไม่เหมาะสมที่จะใช้ระบบ QMS เป็นตัวตรวจจับสำหรับ GC×GC
เพื่อแก้ปัญหานี้ JEOL ได้พัฒนาแมสสเปกโตรมิเตอร์แบบแก๊สโครมาโตกราฟี time-of-flight (ซึ่งต่อไปนี้จะเรียกว่า GC-TOFMS) ที่มีทั้งความละเอียดมวลสูง (R=10,000) และการเก็บข้อมูลแมสสเปกตรัมความเร็วสูง (สูงถึง 50 Hz) ที่เหมาะสมที่สุดสำหรับการรวมกับ GC×GC ระบบ GC×GC-TOFMS แบบผสมผสานนี้เปิดตัวครั้งแรกในปี 2004 และมีการใช้กันอย่างแพร่หลายสำหรับการวิเคราะห์ตัวอย่างที่ซับซ้อนต่างๆ [3-7] ในรายงานนี้ เราใช้ 4 . ของเราth รุ่น GC-TOFMS รุ่น "JMS-T200GC AccuTOF™ GCx" พร้อมแหล่งโฟโตอิออไนเซชันเสริมและระบบ GC×GC เพื่อวิเคราะห์ไบโอมาร์คเกอร์ในตัวอย่างปิโตรเลียม
GC×GC-PI-TOFMS ระบบ
ระบบ GC×GC
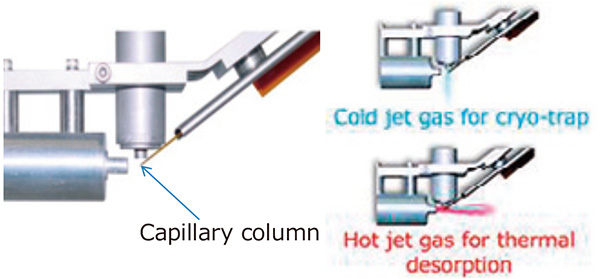
มีการใช้ระบบโมดูเลเตอร์ความร้อน Zoex Corporation ZX2 GC×GC กับระบบ GC-TOFMS ของเรา แผนผังไดอะแกรมของโมดูเลเตอร์ความร้อน GC×GC แสดงในรูปที่ 1 หน่วยโมดูเลเตอร์นี้ถูกวางไว้ระหว่างคอลัมน์เส้นเลือดฝอยสองคอลัมน์เพื่อดักจับส่วนประกอบที่ชะออกจากคอลัมน์แรกโดยใช้ "ก๊าซเย็น" และเพื่อที่จะ ปล่อยพวกเขาโดยใช้ "แก๊สไอพ่นร้อน" เนื่องจากการพ่น "แก๊สร้อน" เป็นระยะเวลาสั้นมาก (300-400 มิลลิวินาที) โดยมีช่วงเวลาปกติ (5-10 วินาที) ส่วนประกอบที่ปล่อยออกมาจะถูกนำเข้าสู่คอลัมน์ที่สองในแต่ละช่วงเวลาอย่างสม่ำเสมอ ส่งผลให้มีการแยกโครมาโตกราฟีแบบสองมิติ สำเร็จดังแสดงในรูปที่ 2
รูปที่ 1 แผนผังของโมดูเลเตอร์ GC×GC
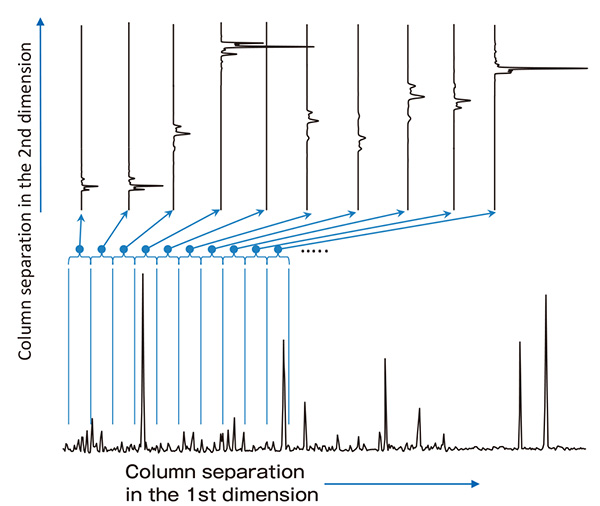
รูปที่ 2 มุมมองแนวคิดของโครมาโตแกรม 2 มิติที่ได้จาก GC×GC
แหล่งกำเนิดแสง (PI)
วิธีการแตกตัวเป็นไอออนที่ใช้กันมากที่สุดสำหรับ GC-MS คือ Electron Ionization (EI) EI เป็นเทคนิคฮาร์ดไอออไนเซชันซึ่งใช้อิเล็กตรอนพลังงานสูงเพื่อทำให้สารที่วิเคราะห์แตกตัวเป็นไอออน ส่งผลให้มีชิ้นส่วนไอออนจำนวนมาก สเปกตรัมมวลเหล่านี้มีประโยชน์มากสำหรับการวิเคราะห์โครงสร้างทางเคมีของสารประกอบเป้าหมาย และสามารถนำไปเปรียบเทียบกับไลบรารีการค้นหาของ MS เช่นฐานข้อมูล NIST เพื่อช่วยยืนยันเอกลักษณ์ของสารประกอบเป้าหมาย อย่างไรก็ตาม สเปกตรัม EI มักจะมีไอออนของโมเลกุลความเข้มต่ำ ซึ่งทำให้ยากต่อการประมาณองค์ประกอบองค์ประกอบจากมวลที่แน่นอนที่วัดได้ ด้วยเหตุนี้ เทคนิคนี้จึงไม่ใช่วิธีการไอออไนซ์ในอุดมคติเสมอไปสำหรับวัตถุประสงค์เหล่านี้ อีกทางหนึ่ง เทคนิคการแตกตัวเป็นไอออนแบบอ่อนที่ใช้วิธีพลังงานต่ำในการแตกตัวเป็นไอออนของสารวิเคราะห์ตัวอย่าง สามารถใช้เพื่อสร้างไอออนของโมเลกุลที่มีความเข้มข้นสูงขึ้นได้ ในด้านการวิเคราะห์ GC-MS การทำให้เป็นไอออนเคมี (CI) เป็นวิธีการไอออไนซ์แบบอ่อนที่ใช้กันทั่วไปมากที่สุด JEOL ไม่เพียงแต่นำเสนอ CI เท่านั้น แต่ยังมี Field Ionization (FI) และ Photoionization (PI) เป็นวิธีการเลือกอิออไนซ์แบบซอฟต์สำหรับ JMS-T200GC
แหล่งกำเนิดโฟตอน PI คือหลอดดิวเทอเรียมที่มีความยาวคลื่นรังสีตั้งแต่ 115 ถึง 400 นาโนเมตร พลังงานสำหรับความยาวคลื่นที่เล็กที่สุด (115 นาโนเมตร) คือ 10.8 eV ซึ่งเหมาะสมกับพลังงานไอออไนซ์เบื้องต้นสำหรับสารประกอบอินทรีย์ทั่วไป (~10 eV) ด้วยเหตุนี้ แหล่งนี้จึงเหมาะสำหรับการไอออไนซ์แบบอ่อนของสารวิเคราะห์ประเภทนี้
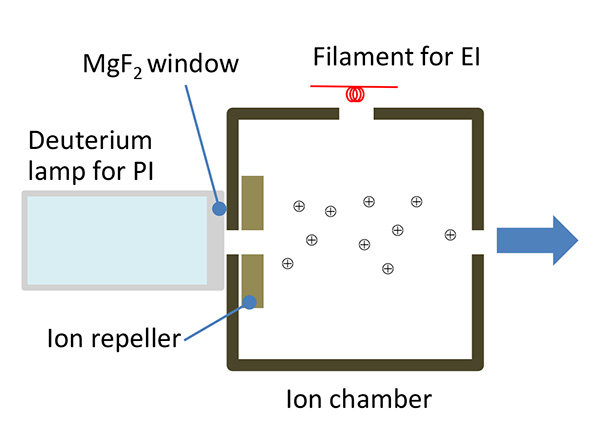
แผนผังแหล่ง PI แสดงในรูปที่ 3 แหล่ง JEOL PI รวมอยู่ในแหล่ง EI มาตรฐาน ซึ่งช่วยให้มีความสามารถเฉพาะตัวในการสลับระหว่าง EI และ PI โดยไม่ทำลายสุญญากาศ สิ่งที่จำเป็นสำหรับการวัด EI ก็คือการเปิดไส้หลอด EI จากนั้นสำหรับการวัด PI เพียงแค่ปิดไส้ EI แล้วเปิดหลอดดิวเทอเรียม
รูปที่ 3 แผนผังของแหล่งที่มา PI (photo ionization)
ระบบ TOFMS ความละเอียดสูง
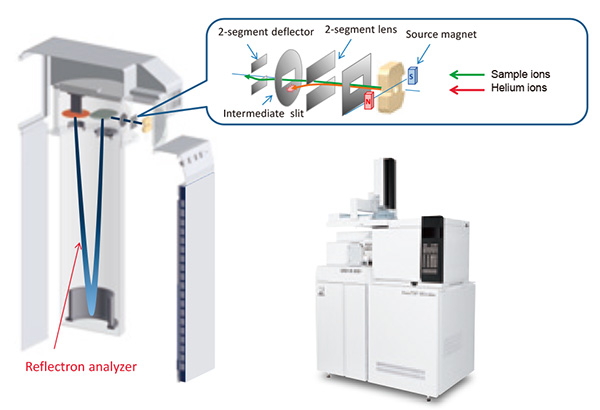
ภาพถ่ายจากมุมมองภายนอกของ JEOL AccuTOF™ GCx พร้อมด้วยแผนผังสำหรับแหล่งกำเนิดไอออน ระบบถ่ายโอนไอออน และระบบออปติคัลไอออนแสดงอยู่ในรูปที่ 4 สารประกอบที่ชะออกจากคอลัมน์ GC จะถูกทำให้เป็นไอออนในแหล่งกำเนิดไอออนเป็นครั้งแรก จากนั้น ถ่ายโอนไปยังเครื่องวิเคราะห์ TOF โดยใช้พลังงานจลน์ต่ำประมาณ 30 eV หลังจากนั้น อิออนจะถูกวัดโดยใช้เครื่องวิเคราะห์ TOF เรคตรอนแบบขั้นตอนเดียวที่เร่งไอออนในแนวตั้งฉากให้ห่างจากทิศทางการถ่ายเทไอออน TOFMS ประเภทนี้เรียกว่า "Orthogonal-Acceleration Time-of-Flight Mass Spectrometer" (oa-TOFMS)
เป็นที่น่าสังเกตว่ามีความท้าทายบางประการในการใช้เครื่องมือ TOF เป็นเครื่องตรวจจับ GC-MS โดยเฉพาะอย่างยิ่ง ก๊าซฮีเลียมถูกใช้เป็นก๊าซพาหะ GC ซึ่งหมายความว่าปริมาตรของก๊าซนี้ค่อนข้างมากเมื่อเทียบกับสารประกอบเป้าหมายที่มีอยู่ในการฉีดตัวอย่าง สำหรับ EI ฮีเลียมยังถูกทำให้แตกตัวเป็นไอออนและถ่ายโอนร่วมกับไอออนของตัวอย่างไปยังเครื่องวิเคราะห์ ซึ่งส่งผลให้มีฮีเลียมไอออนจำนวนมากในลำไอออน อิออนเหล่านี้สามารถสร้างเอฟเฟกต์การชาร์จพื้นที่ขนาดใหญ่ (การชาร์จ ฯลฯ) ภายในเครื่องวิเคราะห์ที่สามารถลดความละเอียดของอุปกรณ์ได้ นอกจากนี้ สำหรับเครื่องวิเคราะห์ TOFMS ฮีเลียมไอออนเหล่านี้จะไปถึงเครื่องตรวจจับ ส่งผลให้แผ่นไมโครแชนเนล (MCP) เสื่อมสภาพอย่างรวดเร็ว เพื่อแก้ปัญหานี้ ระบบ JEOL GC-TOFMS ได้รับการออกแบบอย่างสร้างสรรค์เพื่อให้ระบบถ่ายเทไอออนกำจัดฮีเลียมไอออนที่ผลิตในแหล่งกำเนิดไอออน 99.9% ขึ้นไปโดยการปรับแรงดันไฟฟ้าสมดุลของเลนส์
รูปที่ 4 ภาพถ่ายและแผนผังของ JMS-T200GC
การวิเคราะห์ไบโอมาร์คเกอร์ของตัวอย่างปิโตรเลียมโดยใช้ GC×GC-PI-TOFMS
ไบโอมาร์คเกอร์ที่บรรจุอยู่ภายในน้ำมันดิบและหินแหล่งที่มาของพวกมันมักจะถูกตรวจสอบเพื่อจัดทำดัชนีตัวอย่างปิโตรเลียมและเพื่อกำหนดต้นกำเนิดของตัวอย่างปิโตรเลียม ไบโอมาร์คเกอร์เป็นสารประกอบอินทรีย์ที่มีต้นกำเนิดจากสิ่งมีชีวิตที่มีอยู่ในวัสดุต้นทางของน้ำมัน โมเลกุลไบโอมาร์คเกอร์เหล่านี้ ซึ่งเป็นตัวบ่งชี้ถึงแหล่งกำเนิดสารอินทรีย์ สภาพแวดล้อมของตะกอน ความสุก ฯลฯ สามารถใช้เพื่อกำหนดต้นกำเนิดของน้ำมันดิบที่ไม่รู้จัก อย่างไรก็ตาม ตัวอย่างปิโตรเลียมประกอบด้วยไฮโดรคาร์บอนจำนวนหลายร้อยหรือหลายพันชนิด สถานการณ์ที่ซับซ้อนยิ่งขึ้นไปอีก ไบโอมาร์คเกอร์คือไฮโดรคาร์บอนที่มีโครงสร้างเฉพาะที่พบในตัวอย่างปิโตรเลียมที่ซับซ้อนเหล่านี้ ด้วยเหตุนี้ การตรวจหาไบโอมาร์คเกอร์อย่างครอบคลุมภายในตัวอย่างปิโตรเลียมจึงเป็นเรื่องยากมากที่จะบรรลุผล
ในรายงานนี้ เราจะใช้ความสามารถในการแยกระดับสูงของ GC×GC ร่วมกับแหล่ง EI/PI แบบผสมและ TOFMS ที่มีความละเอียดสูงเพื่อตรวจจับไบโอมาร์คเกอร์ภายในตัวอย่างปิโตรเลียมอย่างครอบคลุม
เงื่อนไขการวัด
เงื่อนไขการวัดแสดงอยู่ในตารางที่ 1 ใช้ระบบมอดูเลตความร้อน ZX2 (Zoex Corporation) สำหรับการวัด GC×GC คอลัมน์ BPX5 แบบไม่มีขั้ว (SGE Corporation, ความยาว 30 ม., รหัส 0.25 มม., ความหนาของเฟสของเหลว 0.25 ไมโครเมตร) ถูกใช้สำหรับคอลัมน์แรก คอลัมน์ BPX50 แบบมีขั้วมากกว่า (SGE Corporation, ความยาว 3 ม., ID 0.1 มม., ความหนาของเฟสของเหลว 0.1 ไมโครเมตร) ถูกใช้สำหรับคอลัมน์ที่สอง ตัวอย่างทดสอบสองตัวอย่าง (เศษส่วนของปิโตรเลียม A และ B) ถูกเตรียมไว้สำหรับการทดสอบเหล่านี้ และปริมาณไบโอมาร์คเกอร์ถูกประมาณและเปรียบเทียบสำหรับเศษส่วนแต่ละส่วน
ตารางที่ 1 เงื่อนไขการวัด
| ตราสาร | JEOL AccuTOF™ GC ซีรีส์ |
|---|---|
| ตัวปรับความร้อน Zoex ZX2 | |
| 1st คอลัมน์ | BPX5, 30 ม. × 0.25 มม., 0.25 ไมโครเมตร |
| 2nd คอลัมน์ | BPX50, 3 ม. × 0.1 มม., 0.1 ไมโครเมตร |
| โมดูเลเตอร์ระยะเวลา | 6 วินาที |
| แรงดันขาเข้า | 350 kPa (กระแสออก : 1.75 มล. / นาที) |
| โหมดทางเข้า | เย็นบนคอลัมน์ โหมดติดตามเตาอบ 1 ไมโครลิตรฉีด |
| อุณหภูมิเตาอบ | 50°C (2 นาที) → 10°C/นาที → 250°C |
| แหล่งไอออน | แหล่งกำเนิดไอออนรวม EI/PI |
| โหมดไอออไนซ์ | PI+ (ด2 หลอดไฟ 115~400 นาโนเมตร) |
| ม./ซ พิสัย | ม./ซ 35 700 ~ |
| ความเร็วในการบันทึกสเปกตรัม | 25 สเปกตรัม / วินาที |
ผลการวัด
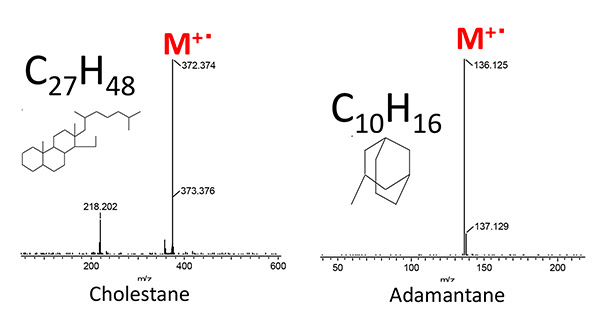
สเปกตรัมมวล PI สำหรับ Cholestane และ Adamantane ซึ่งทั้งสองอย่างนี้เป็นตัวบ่งชี้ทางชีวภาพทั่วไป แสดงไว้ในรูปที่ 5 โมเลกุลไอออน M- ตรวจพบว่าเป็นพีคฐานสำหรับสารประกอบเหล่านี้แต่ละชนิด จึงเป็นการยืนยันว่า PI มีประสิทธิภาพในการตรวจหาไอออนโมเลกุลของไบโอมาร์คเกอร์เหล่านี้
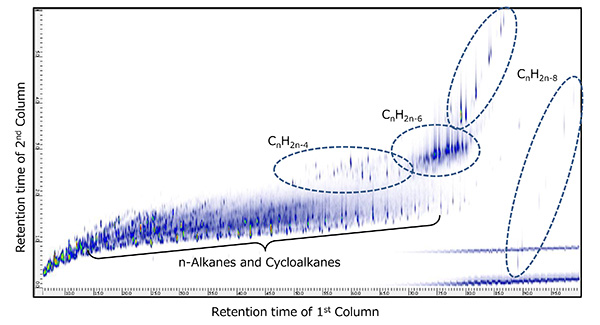
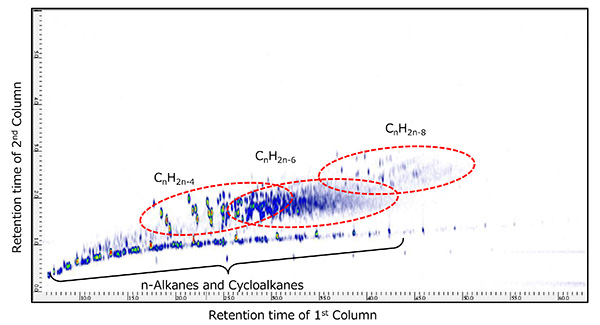
2D TICCs (โครมาโตแกรมของกระแสไอออนทั้งหมด) สำหรับการวัด GC×GC/PI แสดงในรูปที่ 6 และรูปที่ 7 สำหรับตัวอย่างน้ำมันดิบแต่ละตัวอย่าง ตัวอย่างทั้งสองมี n-Alkanes (CnH2n + 2) และไซโคลอัลเคน (CnH2n + 1) พร้อมกับสารประกอบทางเคมีจำนวนมากที่ตรวจพบในเวลาการกักเก็บคอลัมน์ทุติยภูมิในภายหลัง สารประกอบเหล่านี้ถูกระบุว่าเป็น CnH2n-4, CnH2n-6 และ CnH2n-8 ซึ่งมีระดับความไม่อิ่มตัวสูงกว่า n-Alkanes และ Cycloalkanes นอกจากนี้ ตัวอย่างเศษปิโตรเลียมทั้งสองนี้ถูกวัดโดย GC×GC/EI ภายใต้เงื่อนไขเดียวกัน อิงจากผลการค้นหาห้องสมุดสำหรับสเปกตรัมมวล EI ที่สอดคล้องกับ CnH2n-4, CnH2n-6 และ CnH2n-8, เศษส่วนของปิโตรเลียม A ส่วนใหญ่ประกอบด้วย Cholestane polycyclic อิ่มตัวไฮโดรคาร์บอนในขณะที่ Petroleum Fraction B ส่วนใหญ่ประกอบด้วย Adamantene อิ่มตัว-bridged cyclic ไฮโดรคาร์บอน
ขั้นต่อไป มีการสร้าง EIC 2D หัวกะทิสูง (Extracted Ion Chromatograms) สำหรับโมเลกุลไอออนของสารประกอบเคมี 2 ชนิดที่เรียกกันทั่วไปว่าไบโอมาร์คเกอร์ (ตารางที่ 8) ดังแสดงในรูปที่ 9 และรูปที่ 18, 2-Norabietane, Cholestane และ Hopane ถูกระบุอย่างจำเพาะใน Petroleum Fraction A และ Adamantane, Iceane และ Diamantane ถูกระบุใน Petroleum Fraction B จากนั้น สารประกอบที่เกี่ยวข้องสำหรับ biomarkers เหล่านี้ได้รับการประเมินอย่างเป็นระบบ โดยการสร้าง EIC แบบรวม XNUMX มิติสำหรับ CnH2n-4, CnH2n-6 และ CnH2n-8 ชุด. 2D EIC สำหรับซีรีส์เหล่านี้แสดงในรูปที่ 10 และภาพที่ 11
ผลลัพธ์เหล่านี้แสดงให้เห็นชัดเจนว่าไบโอมาร์คเกอร์และสารประกอบที่เกี่ยวข้องมีอยู่ภายในแต่ละส่วนของปิโตรเลียม เนื่องจากวิธีการ PI คัดเลือกผลิตไอออนโมเลกุลสำหรับการวิเคราะห์เหล่านี้ การประเมินอย่างเป็นระบบสำหรับปริมาณไบโอมาร์คเกอร์จึงทำได้โดยการรวมความสามารถในการแยกระดับสูงของ GC×GC เข้ากับไอออไนซ์แบบอ่อนของ PI และ TOFMS ความละเอียดสูง นอกจากนี้ 2D EIC สำหรับการวัด PI ทำให้ตีความข้อมูลได้ง่ายขึ้นมากและกำหนดเอกลักษณ์ของไบโอมาร์คเกอร์ในตัวอย่างน้ำมันดิบได้อย่างถูกต้อง
รูปที่ 5 PI มวลสเปกตรัมของ Cholestane และ Adamantane
รูปที่ 6 2D TIC ของเศษส่วนปิโตรเลียม A วัดโดย GC×GC/PI
รูปที่ 7 2D TIC ของเศษส่วนของปิโตรเลียม B วัดโดย GC×GC/PI
รูปที่ 8 2D EIC ของเศษส่วนปิโตรเลียม A วัดโดย GC×GC/PI
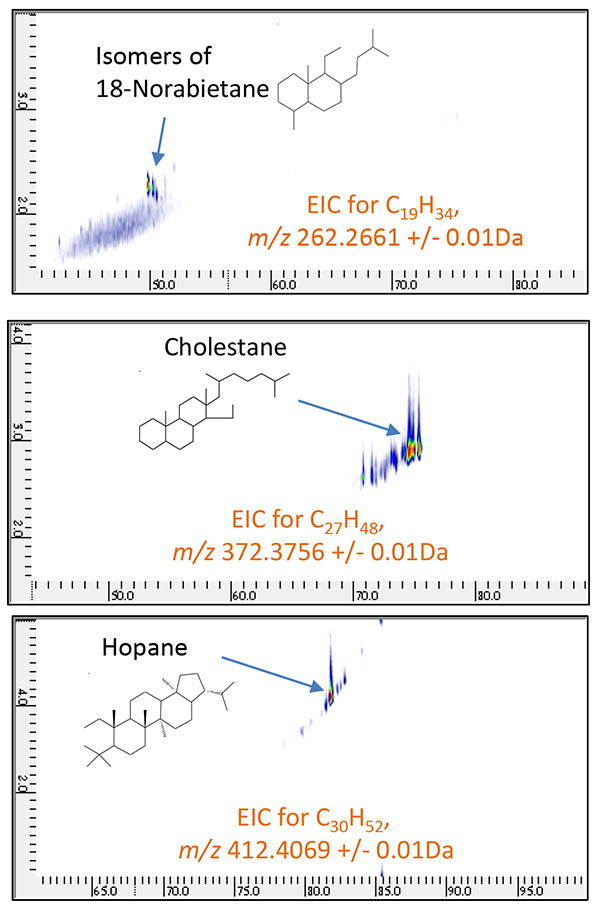
( ม./ซ 262.2661, 372.3756, 412.4069 )
รูปที่ 9 2D EIC ของเศษส่วนของปิโตรเลียม B วัดโดย GC×GC/PI
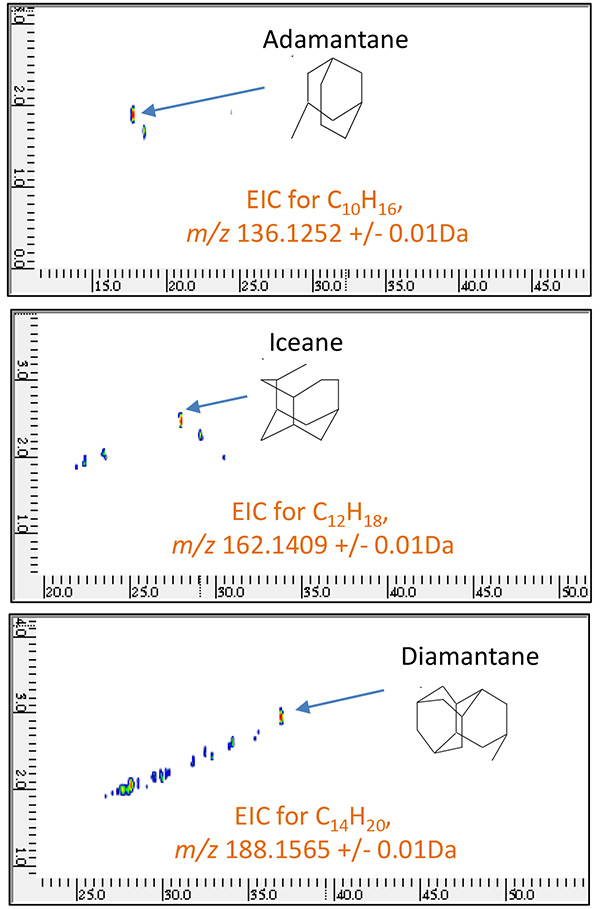
( ม./ซ 136.1252, 162.1409, 188.1565 )
รูปที่ 10 รวม 2D EIC ของเศษส่วนปิโตรเลียม A วัดโดย GC×GC/PI
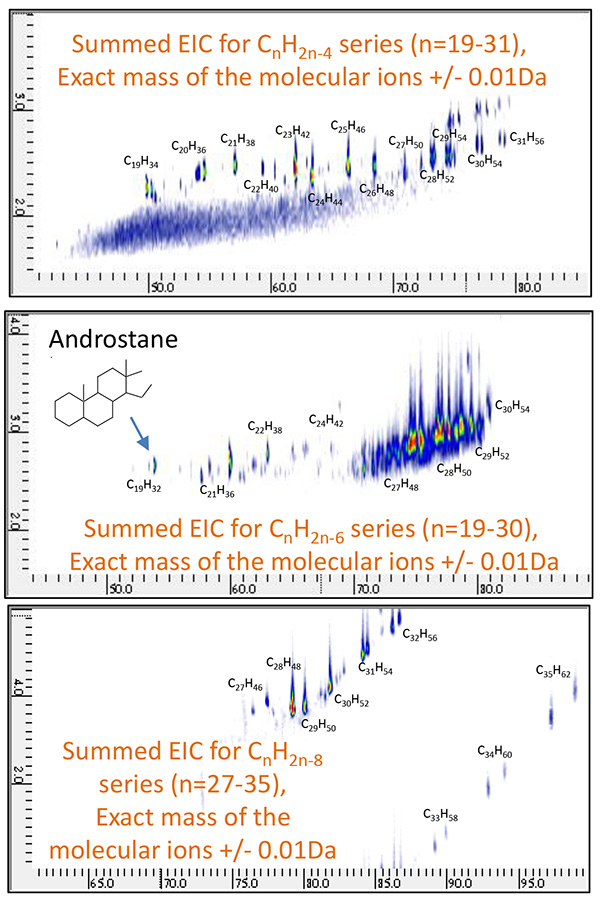
( คnH2n-4 : n=19~31 คnH2n-6 : n=19~31 คnH2n-8 : n=27~35 )
รูปที่ 11 รวม 2D EIC ของเศษปิโตรเลียม B วัดโดย GC×GC/PI
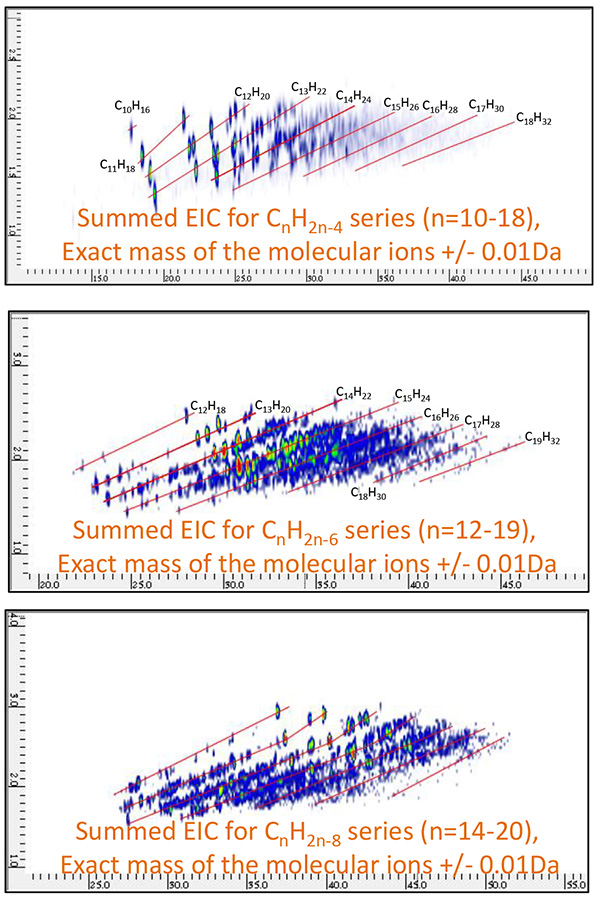
( คnH2n-4 : n=10~18 คnH2n-6 : n=12~19 คnH2n-8 : n=14~20 )
ตารางที่ 2 ตัวบ่งชี้ทางชีวภาพทั่วไปและ "ม./ซ" ของโมเลกุลไอออน
| สารประกอบ | สูตรเหตุผล | ม./ซ |
|---|---|---|
| 18-โนราบีทาเน | C19H34 | 262.2661 |
| คอเลสเตอรอล | C27H48 | 373.3756 |
| โฮเพน | C30H52 | 412.4069 |
| อดามันทาเน่ | C10H16 | 136.1252 |
| ไอซ์เน่ | C12H18 | 162.1409 |
| เพชร | C14H20 | 188.1565 |
สรุป
GC×GC เป็นเทคโนโลยี GC ขั้นสูงที่มีความสามารถในการแยกโครมาโตกราฟีที่สูงกว่าเทคโนโลยี 1D GC ทั่วไปอย่างมาก เพื่อเพิ่มคุณภาพของข้อมูลที่ได้รับด้วยความสามารถในการแยกในระดับสูงนี้ ควรใช้ TOFMS ที่ให้ทั้งการรับข้อมูลความเร็วสูงและความละเอียดมวลสูงร่วมกับวิธีฮาร์ดไอออไนซ์และซอฟต์ไอออไนซ์ ระบบ JEOL GC×GC-TOFMS ที่ติดตั้งแหล่ง EI/PI แบบผสมผสาน ทำให้ทั้งหมดนี้สำเร็จในแพ็คเกจเดียว
ตามที่รายงานในบันทึกการใช้งานนี้ GC×GC-TOFMS ล่าสุดของเราร่วมกับแหล่ง EI/PI ที่เป็นตัวเลือกเป็นเครื่องมือที่ทรงพลังมากสำหรับการวิเคราะห์สารผสมที่ซับซ้อน เช่น ไบโอมาร์คเกอร์ในตัวอย่างปิโตรเลียม
อ้างอิง
- ซี. หลิว, เจบี ฟิลลิปส์, เจ. โครมาโตกร์. วิทย์. 29 227 (1991)
- เจซี กิดดิงส์, ก้น เคมี., 56 1258A (1984)
- GERSTEL KK Japan, N. Ochiai, "การวิเคราะห์สารปนเปื้อนในสิ่งแวดล้อมด้วยปริมาณไมโครมากเป็นพิเศษโดยใช้ GC×GC-TOFMS", การประชุมผู้ใช้ JEOL MS (2008) (ภาษาญี่ปุ่น)
- เอส. ฮาชิโมโตะ, วาย. ทาคาซาว่า, เอ. ฟูชิมิ, เอช. อิโตะ, เค.ทานาเบะ, วาย. ชิบาตะ, เอ็ม. อูบุกาตะ, เอ. คูไซ, เค. ทานากะ, เอช. โอสึกะ, เค. อาเนะซากิ, เจ. โครมาโตกร์. ก. 1178 187 (2008)
- Kyushu Environmental Evaluation Association, M. Ueda, "การวิเคราะห์เชิงคุณภาพและเชิงปริมาณของสารประกอบอินทรีย์ในน้ำมันเชื้อเพลิงโดยใช้ GC×GC-HRTOFMS", JEOL MS Users Meeting (2010) (ภาษาญี่ปุ่น)
- ข่าวนิฮอนเดนชิ ฉบับ 44 (2017), p40 ถึง 49 (เป็นภาษาญี่ปุ่น).
- อนุปัม คีรี, et al., ก้น เคมี., 89 (10) (2017), หน้า 5395-5403.
สินค้าที่เกี่ยวข้อง
การแก้ปัญหาตามสาขา
คุณเป็นผู้เชี่ยวชาญทางการแพทย์หรือบุคลากรที่เกี่ยวข้องกับการรักษาพยาบาลหรือไม่?
ไม่
โปรดทราบว่าหน้าเหล่านี้ไม่ได้มีวัตถุประสงค์เพื่อให้ข้อมูลเกี่ยวกับผลิตภัณฑ์แก่ประชาชนทั่วไป
