X-ray, Electron และ NMR Crystallography เพื่อกำหนดโครงสร้างของโมเลกุลอินทรีย์ขนาดเล็ก
JEOL NEWS ฉบับที่ 53 No.6
ยูสุเกะ นิชิยามะ1, 2
1 บริษัท จอล เรโซแนนซ์ 2 ศูนย์ความร่วมมือ RIKEN CLST-JEOL
ที่นี่ เราขอนำเสนอการพัฒนาล่าสุดที่ห้องปฏิบัติการการทำงานร่วมกันของ RIKEN CLST-JEOL เพื่อสำรวจโครงสร้างโมเลกุลของสารประกอบทางเภสัชกรรมที่มีน้ำหนักโมเลกุลต่ำในความอุดมสมบูรณ์ตามธรรมชาติ (ไม่มีการติดฉลากไอโซโทป) ความก้าวหน้าล่าสุดในเทคโนโลยีการหมุนมุมด้วยเวทย์มนตร์อย่างรวดเร็ว (MAS) ในโซลิดสเตตนิวเคลียร์เรโซแนนซ์แม่เหล็กเรโซแนนซ์ (ssNMR) และในกล้องความไวสูงพิเศษในกล้องจุลทรรศน์อิเล็กตรอนแบบส่องผ่าน (TEM) เป็นการปูทางใหม่ในการตอบปัญหาในอุตสาหกรรมยาและวิทยาศาสตร์ 1) ผลึกโพลีมอร์ฟและ 2) เกลือ/โคคริสตัลเป็นข้อกังวลหลักสองประการในแง่ของการควบคุมคุณภาพ ความเสถียร และทรัพย์สินทางปัญญา เพื่อระบุรูปแบบผลึก การเลี้ยวเบนของรังสีเอกซ์แบบผง และ 13C cross-polarization MAS ssNMR เป็นวิธีที่ใช้กันอย่างแพร่หลาย อย่างไรก็ตาม วิธีแรกอาจไม่เหมาะสำหรับการวิเคราะห์ส่วนผสม และวิธีหลังล้มเหลวในการแยกแยะรูปแบบผลึกที่มีโครงสร้างโมเลกุลคล้ายกัน เพื่อแก้ปัญหาเหล่านี้ เราใช้การเลี้ยวเบนของอิเล็กตรอน (ED) และ 1H เร็ว MAS NMR รูปแบบผลึกสามารถกำหนดได้จากผลึกเดี่ยวขนาดนาโนถึงไมโครเมตรโดยใช้ ED เนื่องจากปฏิกิริยาของอิเล็กตรอนมีความแข็งแกร่งกว่าปฏิกิริยาเอ็กซ์เรย์ 4-5 ลำดับ 1H NMR ยังให้ข้อมูลที่เหมาะสมกับการบรรจุโมเลกุลตั้งแต่ 1H ตั้งอยู่ที่พื้นผิวของผลึก ปัญหาเกลือ/ผลึกคริสตัล ซึ่งไฮโดรเจนมีบทบาทสำคัญ เป็นปัญหาร้ายแรง เนื่องจากการเลี้ยวเบนรังสีเอกซ์แบบผลึกเดี่ยว (SCXRD) ไม่สามารถระบุตำแหน่งอะตอมของไฮโดรเจนได้อย่างแม่นยำ ที่นี่เรากำหนดระยะทางระหว่างนิวเคลียร์ระหว่าง 1H และ 15N ใช้ ssNMR ที่สภาวะ MAS ที่รวดเร็ว ในขณะที่โครงสร้างส่วนกลางได้รับผ่าน SCXRD เพื่อตอบคำถามเกี่ยวกับเกลือ/คริสตัล
บทนำ
แม้ว่ายาที่ใช้เทคโนโลยีชีวภาพจะอยู่ในรายชื่อหุ้นอันดับต้นๆ ในตลาดยา แต่ยาแผนโบราณที่มีน้ำหนักโมเลกุลต่ำยังคงมีความสำคัญมากสำหรับการรักษาในแต่ละวัน เช่น โรคในผู้ใหญ่ ส่วนผสมทางเภสัชกรรมที่มีน้ำหนักโมเลกุลต่ำ (APIs) โดยทั่วไปสามารถตกผลึกได้หลายรูปแบบ เช่น ผลึกโพลีมอร์ฟ ขึ้นอยู่กับสภาวะการตกผลึก เนื่องจากความสามารถในการละลายและความเสถียรส่วนใหญ่ได้รับผลกระทบจากรูปแบบผลึก การควบคุมและตรวจสอบรูปแบบผลึกในมุมมองของการควบคุมคุณภาพจึงเป็นสิ่งสำคัญมากตั้งแต่การพัฒนาจนถึงขั้นตอนการผลิต [1, 2, 3] เมื่อมีคริสตัลที่มีขนาดเพียงพอ (~100 ไมโครเมตร) การเลี้ยวเบนรังสีเอกซ์แบบผลึกเดี่ยว (SCXRD) จะให้คำตอบที่ชัดเจนสำหรับรูปแบบผลึกที่มีความละเอียดของอะตอม อย่างไรก็ตาม ยาที่มีน้ำหนักโมเลกุลต่ำส่วนใหญ่มีให้ในรูปแบบไมโครคริสตัลไลน์ที่มีสูตรต่างๆ รวมถึงยาเม็ด ยาเม็ด ผง เนื่องจากสูตรเหล่านี้เกี่ยวข้องกับส่วนเติมเนื้อยา จึงเป็นสิ่งสำคัญในการกำหนดหารูปแบบผลึกจากไมโครคริสตัลในของผสม การเลี้ยวเบนของรังสีเอกซ์แบบผง (PXRD) และ 13C การหมุนด้วยคลื่นแม่เหล็กไฟฟ้าแบบนิวเคลียส (CPMAS NMR) เป็นวิธีการหลักสองวิธีในการระบุรูปแบบผลึก เนื่องจากรูปแบบการทดลอง/สเปกตรัมแสดงลายนิ้วมือของรูปแบบผลึกแต่ละรูปแบบ การเปรียบเทียบรูปแบบ/สเปกตรัมระหว่างยาและรูปแบบมาตรฐานจะให้คำตอบที่ชัดเจนสำหรับผลึกจากในนั้น ในกรณีส่วนใหญ่ อย่างไรก็ตาม ทั้งสองวิธียังคงมีปัญหาในทางปฏิบัติ บางครั้ง PXRD ล้มเหลวในการระบุรูปแบบผลึกเนื่องจากการเลี้ยวเบนจาก API และสารเพิ่มปริมาณที่ซ้อนทับกัน ในทางกลับกัน, 13C CPMAS ซึ่งไวต่อการจัดรูปแบบโมเลกุลเป็นวิธีที่เหมาะสมสำหรับการวิเคราะห์ของผสม เนื่องจากสัญญาณส่วนใหญ่จากส่วนเติมเนื้อยาปรากฏที่ตำแหน่งที่แตกต่างจากสัญญาณจาก API โดยหลีกเลี่ยงการซ้อนทับกันของสัญญาณ อย่างไรก็ตาม, 13C CPMAS ค่อนข้างไม่ไวต่อการบรรจุโมเลกุลเนื่องจากอะตอมของคาร์บอนถูกฝังอยู่ภายในโมเลกุลและอยู่ห่างจากพื้นผิวโมเลกุล ดังนั้น 13C CPMAS ล้มเหลวในการระบุรูปแบบผลึกที่มีรูปแบบโมเลกุลคล้ายคลึงกัน นอกจากนี้ ความไวต่อรูปแบบผลึกยังน้อยกว่า PXRD
ปัญหาสำคัญอื่นๆ ใน API ที่มีน้ำหนักโมเลกุลต่ำคือวิธีการระบุเกลือ/โคคริสตัล/ความต่อเนื่องในระบบที่มีหลายองค์ประกอบ บางครั้งจำเป็นต้องปรับปรุงความสามารถในการละลายและ/หรือความเสถียรของผลึก API ระบบหลายองค์ประกอบที่ประกอบด้วย API และ coformer เฉื่อยเป็นหนึ่งในวิธีแก้ปัญหาที่ใช้กันอย่างแพร่หลายสำหรับปัญหานี้ ตัวอย่างมากมายสามารถพบได้ในระบบที่มีหลายองค์ประกอบโดยการผสม (โดยทั่วไปคือพื้นฐาน) API และ (ที่เป็นกรด) coformer เมื่อความแตกต่างของ pKa (ΔpKa) มากกว่า 3 จะเกิดเป็นเกลือ ซึ่งจะพบปฏิกิริยาระหว่างโมเลกุลของไอออนิก ในเกลือ โปรตอนจากโคฟอร์มเมอร์จะเคลื่อนเข้าหา API โดยสิ้นเชิง เมื่อเร็ว ๆ นี้ ระบบหลายองค์ประกอบอีกประเภทหนึ่งคือ cocrystal ถูกนำมาใช้เมื่อ ΔpKa น้อยกว่า 3 ใน cocrystal โปรตอนใน coformer ยังคงอยู่ที่นั่นและเกิดพันธะไฮโดรเจนระหว่างโมเลกุล นอกจากนี้ ยังพบระบบระหว่างเกลือและผลึกคริสตัล เช่น คอนตินิวอัมที่โปรตอนตั้งอยู่ระหว่าง API และโคฟอร์มเมอร์ จำเป็นอย่างยิ่งที่จะต้องระบุเกลือ/คริสตัล/ความต่อเนื่องในแง่ของมุมมองทางปัญญา โดยเฉพาะอย่างยิ่งเมื่อ ΔpKa น้อยกว่า 3 อย่างไรก็ตาม การขาดความสามารถในการระบุตำแหน่งของโปรตอนในวิธีที่เป็นฐานของ XRD ทำให้เกิดปัญหาร้ายแรงต่อการระบุเกลือ/โคคริสตัล/ ต่อเนื่อง เนื่องจากความแตกต่างระหว่างพวกมันมาจากตำแหน่งไฮโดรเจนเท่านั้น
ประเด็นสำคัญที่ยังไม่ได้รับการแก้ไข ได้แก่ 1) การวิเคราะห์ของผสม 2) การระบุรูปแบบผลึกที่มีโครงสร้างโมเลกุลคล้ายคลึงกัน และ 3) ขาดความสามารถในการกำหนด 1ตำแหน่ง H สองประเด็นก่อนหน้านี้เกี่ยวข้องกับคริสตัลไลน์โพลิมอร์ฟส์ และประเด็นสุดท้ายคือเรื่องเกลือ/โคคริสตัล/ต่อเนื่อง ที่นี่เรารวมการเลี้ยวเบนของอิเล็กตรอน (ED) 1H ssNMR และ SCXRD เพื่อจัดการกับปัญหาเหล่านี้ ED เป็นหนึ่งในวิธีการสังเกตในอุปกรณ์กล้องจุลทรรศน์อิเล็กตรอนแบบส่องผ่าน (TEM) และให้รูปแบบการเลี้ยวเบน เนื่องจากปฏิกิริยาของอิเล็กตรอนมีความแข็งแรงกว่าการเอ็กซ์เรย์ 104 ถึง 105 รูปแบบ ED สามารถสังเกตได้จากผลึกเดี่ยวขนาดนาโนถึงไมโคร ทำให้สามารถวิเคราะห์ส่วนผสมได้ แม้ว่าการใช้ ED ส่วนใหญ่จะจำกัดเฉพาะวัสดุอนินทรีย์ที่ทนทานต่อการฉายรังสีอิเล็กตรอน แต่ความคืบหน้าล่าสุดในกล้องความไวสูงช่วยให้ใช้โหมดขนาดต่ำร่วมกับตัวจับตัวอย่างด้วยความเย็น เป็นการปูทางไปสู่การสังเกต ED ของผลึกอินทรีย์รวมถึงโมเลกุลต่ำ น้ำหนัก API ประเด็นที่ 2) ยกมาเพราะ 13C CPMAS ไม่ไวต่อโครงสร้างโมเลกุลตามที่กล่าวไว้ข้างต้น โชคดีที่การแนะนำเทคโนโลยี MAS ที่รวดเร็วมาก > 70 kHz ช่วยให้มีความละเอียดสูง 1H การสังเกตแม้ในของแข็งแข็ง [4, 5, 6] โดยที่ 1Hs จะแนบชิดกับ 1H-1H ปฏิกิริยาขั้วสองขั้วที่อัตรา MAS ปานกลาง เนื่องจาก 1H ตั้งอยู่ที่พื้นผิว 1การเปลี่ยนแปลงทางเคมีของไอโซโทรปิก H มีความไวต่อโครงสร้างไม่เพียงเท่านั้น แต่ยังรวมถึงการบรรจุโมเลกุลด้วย นอกจากนี้, 1H-1ความสัมพันธ์ระหว่างโมเลกุล H ให้รูปแบบที่แตกต่างกันสำหรับการบรรจุโมเลกุลแต่ละอัน เทคโนโลยี MAS ที่รวดเร็วไม่เพียงให้ความละเอียดสูงเท่านั้น 1H NMR แต่ยังมีการทดลองที่ซับซ้อนอีกหลายอย่าง รวมถึง 14N NMR และ 1H-15N การวัดระยะทาง อดีตเผยให้เห็นสถานะของโปรตอนในโมเลกุลอินทรีย์ขนาดเล็ก อย่างหลังให้คำตอบที่ชัดเจนสำหรับปัญหาเกลือ/คริสตัล/ต่อเนื่องที่ตำแหน่งไฮโดรเจนมีบทบาทสำคัญ นอกจากนี้ เราประเมินปริมาณงานของแต่ละวิธี
ผลึกโพลีมอร์ฟ[7]
การระบุรูปแบบผลึกในการใช้งานทางเภสัชกรรมมีความสำคัญและมักจะดำเนินการโดย PXRD และ 13ซี ซีพีเอ็มเอส เอสเอสเอ็นเอ็มอาร์ อย่างไรก็ตาม แบบแรกไม่เหมาะสำหรับการวิเคราะห์ส่วนผสม และบางครั้งก็ล้มเหลวตามที่กล่าวไว้ข้างต้น ตัวอย่างเช่น, 13สเปกตรัม CPMAS CPMAS ของโพลิมอร์ฟ (หลอก) ที่แตกต่างกันสามชนิดของ L-histidine แสดงไว้ในรูปที่ 1 L-histidine (รูปที่ 1b, c) ให้สเปกตรัมที่แตกต่างจากเกลือไฮโดรคลอไรด์ของ L-histidine·HCl·H2O (รูปที่ 1a) เนื่องจากโครงสร้างโมเลกุลต่างกัน ในทางกลับกัน L-histidine ในรูปแบบ orthorhombic (รูปที่ 1b) และ monoclinic (รูปที่ 1c) ให้เกือบเหมือนกัน 13C CPMAS spectra สะท้อนโครงสร้างที่ใกล้เคียงกัน ดังที่แสดงไว้ที่นี่ 13C CPMAS เป็นหน่วยวัดที่มีความละเอียดอ่อนในการระบุรูปแบบผลึกที่มีรูปแบบต่างกัน อย่างไรก็ตาม ไม่สามารถแยกแยะความแตกต่างของพหุสัณฐานที่มีโครงสร้างโมเลกุลคล้ายคลึงกัน เราขอเสนอแนวทางผสมผสานของ ED และ 1H ssNMR ที่ MAS เร็วมากเพื่อตอบคำถามเหล่านี้
รูปที่ 2 แสดงภาพ TEM และรูปแบบ ED ของ L-histidine·HCl·H2O วัดที่อุณหภูมิห้อง แม้ว่าขนาดของคริสตัลจะอยู่ที่ประมาณ 1 ไมโครเมตร ซึ่งมักพบในผลิตภัณฑ์ยา แต่มีการใช้ลำแสงนาโนขนาด 100 นาโนเมตร ดังนั้น โดยหลักการแล้ว คริสตัลที่มี 100 นาโนเมตรจึงมีขนาดใหญ่พอที่จะได้รูปแบบ ED แบบผลึกเดี่ยว อันที่จริง เรามีการวัดรูปแบบ ED ตั้งแต่ 100 นาโนเมตร หรือแม้แต่คริสตัลที่เล็กกว่า เป็นปริมาณที่สำคัญของ L-histidine·HCl·H2O ที่อุณหภูมิห้องเพียง 10-20 e-nm-2เรากำหนดอัตราปริมาณรังสีเป็น 10 e-nm-2s-1 ด้วยเวลาเปิดรับแสง 1 วินาที ทำให้ได้ปริมาณยาทั้งหมด 10 e-nm-2. แม้ในสภาวะที่มีปริมาณรังสีต่ำมาก กล้อง CMOS อันล้ำสมัย (OneView, Gatan, Inc., USA) ก็ให้ความไวที่เพียงพอ ในขณะที่ปริมาณวิกฤต 10-20 e-nm-2 มักพบในโมเลกุลอินทรีย์ ตัวจับตัวอย่างด้วยความเย็นจะปรับปรุงปริมาณที่สำคัญยิ่งถ้าจำเป็น เนื่องจากรูปแบบ ED สามารถคำนวณได้ง่ายจากโครงสร้างผลึก จึงระบุรูปแบบผลึกได้โดยการเปรียบเทียบรูปแบบ ED ทดลองและคำนวณ รูปแบบ ED ของ L-histidine ในรูปแบบ orthorhombic และ monoclinic แสดงในรูปที่ 3 และรูปที่ 4 ตามลำดับ ในขณะที่ 13C CPMAS ล้มเหลวในการแยกแยะสองรูปแบบนี้ (รูปที่ 1) การเลี้ยวเบนของ ED ให้รูปแบบที่แตกต่างกันสำหรับรูปแบบผลึกแต่ละรูปแบบ เนื่องจากพารามิเตอร์แลตทิซต่างกันโดยสิ้นเชิงในสองรูปแบบนี้ นอกจากนี้ ED ยังช่วยให้สามารถวัดปริมาณงานสูงได้ภายในหนึ่งนาทีเมื่อเทียบกับ PXRD (สิบนาที) และ 13C CPMAS (ชั่วโมง). การวัด ED ดำเนินการโดยใช้ JEM-ARM200F (JEOL Ltd. ประเทศญี่ปุ่น) เครื่องมือ TEM ส่วนใหญ่สามารถวัดได้หากติดตั้งกล้องที่มีความไวสูง
สามารถตรวจสอบการบรรจุโมเลกุลโดยใช้ 1H NMR ที่ MAS ที่เร็วมาก 1D 1H NMR spectra ของ L-histidine (pseudo) polymorphs ที่ 70 kHz MAS แสดงไว้ในรูปที่ 5 ซึ่งให้รูปแบบที่แตกต่างกัน โดยเฉพาะอย่างยิ่ง L-histidine ในรูปแบบ orthorhombic (b) ให้รูปแบบที่แตกต่างจากรูปแบบ monoclinic (c) ความแตกต่างเหล่านี้มาจากการบรรจุโมเลกุลที่แตกต่างกัน สิ่งนี้เน้นถึงข้อดีของ 1H NMR เหนือ 13C CPMAS ซึ่งไม่สามารถระบุรูปแบบผลึกทั้งสองนี้ได้ เนื่องจากมีความอุดมสมบูรณ์สูง (>99%) และความถี่ Larmor (600 MHz ที่ 14.1 T) จึงใช้เวลาน้อยกว่าหนึ่งนาทีในการสังเกตสเปกตรัม 1D เหล่านี้ ความแตกต่างระหว่างรูปแบบผลึกสองรูปแบบสามารถขยายได้โดยการสังเกต 1H/1H การทดลองสหสัมพันธ์แบบโฮโมนิวเคลียส ซึ่งควรมีความไวต่ออินเตอร์โมเลกุล 1H/1การเชื่อมต่อ H ดังนั้นการบรรจุแบบผลึก ความสามารถของความสัมพันธ์แบบโฮโมนิวเคลียร์เป็นหนึ่งในคุณสมบัติพิเศษของ 1H NMR ด้วยความช่วยเหลือของความไวสูงและความอุดมสมบูรณ์ รูปที่ 6 ให้ 2D 1H double-quantum (DQ) / single-quantum (SQ) สเปกตรัมสหสัมพันธ์แบบโฮโมนิวเคลียร์ของ L-histidine ในรูปแบบ orthorhombic และ monoclinic ในขณะที่สเปกตรัม 1D แสดงเฉพาะข้อมูลในพื้นที่ สเปกตรัมสหสัมพันธ์ 2D ยังสะท้อนข้อมูลเกี่ยวกับการบรรจุโมเลกุล ดังที่แสดงไว้อย่างชัดเจนในสเปกตรัมที่ซ้อนทับ เนื่องจากการเชื่อมโยงกันของ DQ ถูกสร้างขึ้นผ่าน 1H-1ปฏิสัมพันธ์เชิงขั้ว H ความเข้มของยอดกากบาทสะท้อนถึงความใกล้ชิดเชิงพื้นที่ ตัวอย่างเช่น ระยะห่างระหว่างนิวเคลียร์ระหว่าง H1 และ H4 คือ 4.1 Å สำหรับ orthorhombic จะสั้นกว่ามากและ 2.86 Å ในรูปแบบโมโนคลินิก แม้ว่าระยะทางจะต่างกันเพียง 1.4 เท่า แต่ก็ส่งผลให้มีปฏิสัมพันธ์แบบขั้วคู่ที่แข็งแกร่งขึ้น 2.9 เท่าในรูปแบบโมโนคลินิก ดังนั้นความสัมพันธ์ของ H1-H4 จึงพบได้เฉพาะในรูปแบบโมโนคลินิกเท่านั้น อย่างไรก็ตาม เป็นการทดลองแบบ 2 มิติ โดยทั่วไปแล้วเวลาในการวัดจะน้อยกว่าหนึ่งชั่วโมง ทำให้ได้ปริมาณงานมากกว่า 13ซี ซีพีเอ็มเอส.
1H/14N สหสัมพันธ์ NMR ยังให้ข้อมูลที่เป็นประโยชน์ แอล-ฮิสติดีนมีสถานะโปรตอนที่เป็นไปได้หลายสถานะ ไนโตรเจนสองตัวหรือทั้งสองตัวที่τและ δ บนวงแหวนอิมิดาโซลอาจถูกโปรตอนไปยังมอยอิตีของ NH นอกจากนี้ L-histidine สามารถเป็น Zwitterion เป็นการท้าทายที่จะแยกแยะสถานะของโปรตอนเหล่านี้ด้วย XRD หรือ ED เนื่องจากทั้งสองวิธีไม่ไวต่อตำแหน่งของไฮโดรเจน อย่างไรก็ตาม, 1H/14N สเปกตรัมสหสัมพันธ์ของ L-histidine (รูปที่ 7) ให้คำตอบที่ชัดเจน ในสภาพแวดล้อมที่เป็นกรดใน L-histidine·HCl·H2O สามความสัมพันธ์ของ NH ปรากฏขึ้น นี่แสดงให้เห็นอย่างชัดเจนว่าทั้ง τ และ δ ไนโตรเจนถูกโปรตอน ความสัมพันธ์ของ NH เพิ่มเติมปรากฏขึ้นที่ตำแหน่งความถี่ต่ำใน 14ขนาด N ที่ -260 ppm แนะนำว่ากรดอะมิโนนี้คือสวิตเตอร์ไอออนกับ NH3+ มอยอิตี นี่เป็นเพราะการมีเพศสัมพันธ์แบบสี่ขั้วขนาดเล็กใน NH3+ เนื่องจากความสมมาตรของท้องถิ่น ในทางกลับกัน โพลิมอร์ฟของ L-histidine สองตัวจะให้พีค NH เพียงสองค่าสำหรับแต่ละตัว เป็นที่ชัดเจนว่าทั้งคู่เป็นสวิตเตอร์ไอออนและมีโปรตอนเพียงหนึ่งของ τ และ δ ไนโตรเจน ควรสังเกตว่า 1H/14โดยปกติ N ใช้เวลาน้อยกว่า 10 นาทีเพราะทั้งสองอย่าง 1H และ 14N เป็นนิวเคลียสที่อุดมสมบูรณ์
การวัดทั้งหมดข้างต้นดำเนินการโดยใช้สเปกโตรมิเตอร์ JNM-ECZ600R (JEOL RESONANCE Inc. ประเทศญี่ปุ่น) ที่ติดตั้งโพรบ MAS ssNMR แบบเร็ว 1 มม. (JEOL RESONANCE Inc.) ที่ 14.1 ต. ปริมาณตัวอย่างที่ใช้ในการวัดจะอยู่ที่ประมาณ 1 มก. สำหรับแต่ละรายการ .
Fig.1
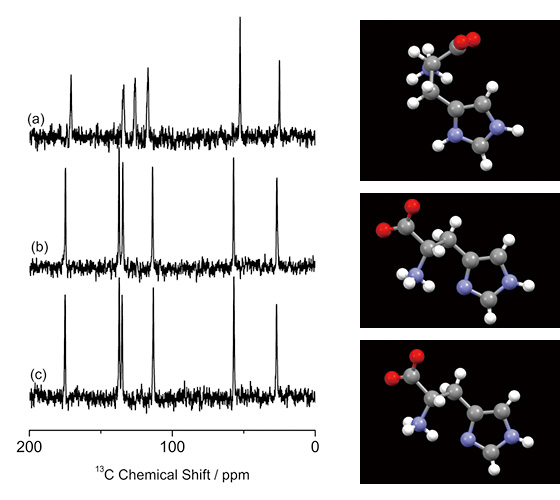
13C CPMAS สเปกตรัมของ (a) L-histidine·HCl·H2O, (b) L-histidine (orthorhombic) และ (c) L-histidine (monoclinic) ร่วมกับโครงสร้างโมเลกุล การสแกน 256 ครั้งสำหรับ (a) และการสแกน 512 ครั้งสำหรับ (b) และ (c) (a) วัดที่ 16.4 T ด้วยสเปกโตรมิเตอร์ JNM-ECA700II (JEOL RESONANCE Inc. ประเทศญี่ปุ่น) รูปภาพนี้ทำซ้ำจากการอ้างอิง 7
Fig.2

(a) ภาพ TEM และ (b) นาโนบีม (เส้นผ่านศูนย์กลาง 100 นาโนเมตร) รูปแบบการเลี้ยวเบนของไมโครคริสตัลไลน์ L-histidine·HCl·H2โอ ตัวอย่าง. รูปแบบการเลี้ยวเบนได้มาจากพื้นที่ที่ระบุโดยวงกลมสีขาวใน (a) รูปภาพนี้ทำซ้ำจากการอ้างอิง 7
Fig.3
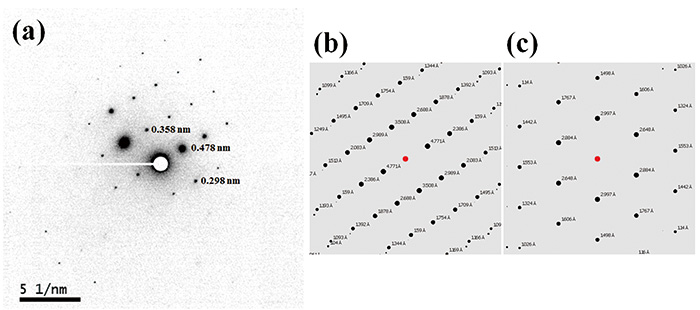
(a) รูปแบบ ED ทดลองที่แสดงในเชิงลบสำหรับ L-histidine (orthorhombic) และรูปแบบ ED ที่คำนวณได้สำหรับ (b) L-histidine (orthorhombic) และ (c) L-histidine (monoclinic) ระยะห่าง d ที่สอดคล้องกับจุดเลี้ยวเบนนั้นประเมินโดยความยาวของกล้องที่ปรับเทียบแล้วที่ 40 ซม. และความยาวคลื่นที่ 2.51 น. ที่แรงดันไฟฟ้าเร่ง 200 kV รูปแบบ ED คำนวณสำหรับลำแสงตกกระทบแกนโซน [631] รูปภาพนี้ทำซ้ำจากการอ้างอิง 7
Fig.4

(a) รูปแบบ ED ทดลองที่แสดงในเชิงลบสำหรับ L-histidine (monoclinic) และรูปแบบ ED ที่คำนวณได้สำหรับ (b) L-histidine (orthorhombic) และ (c) L-histidine (monoclinic) ระยะห่าง d ที่สอดคล้องกับจุดเลี้ยวเบนนั้นประเมินโดยความยาวของกล้องที่ปรับเทียบแล้วที่ 40 ซม. และความยาวคลื่นที่ 2.51 น. ที่แรงดันไฟฟ้าเร่ง 200 kV รูปแบบ ED คำนวณสำหรับลำแสงตกกระทบแกนโซน [100] รูปภาพนี้ทำซ้ำจากการอ้างอิง 7
Fig.5
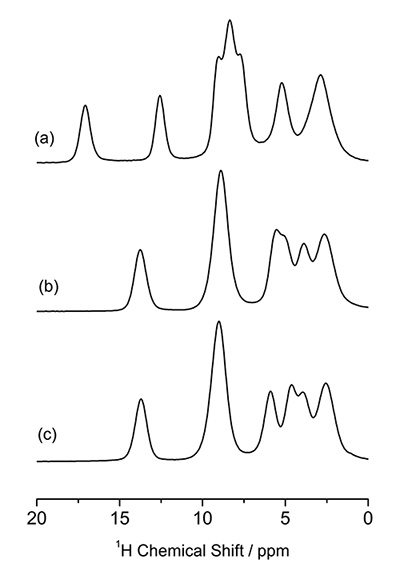
พื้นที่ 1H NMR สเปกตรัมของ (a) L-histidine·HCl·H2O, (b) L-histidine (orthorhombic) และ (c) L-histidine (monoclinic) ตัวเลขนี้ทำซ้ำจากการอ้างอิง 7
Fig.6
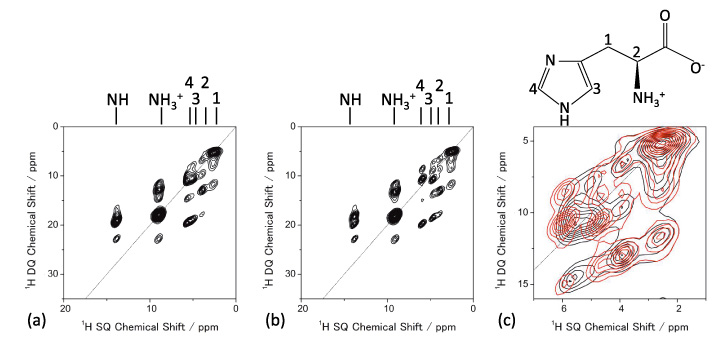
1เอช ดีคิว/1H SQ NMR สเปกตรัมของ (a) L-histidine (orthorhombic) และ (b) L-histidine (monoclinic) การขยายตัวของสเปกตรัมที่ซ้อนทับแสดงไว้ใน (c) (L-histidine (orthorhombic) เป็นสีดำและ L-histidine (monoclinic) เป็นสีแดง) สี่สแกนสำหรับแต่ละ t1 ระยะเวลาสะสม 32 t1 เพิ่มขึ้น รูปภาพนี้ทำซ้ำจากการอ้างอิง 7
Fig.7
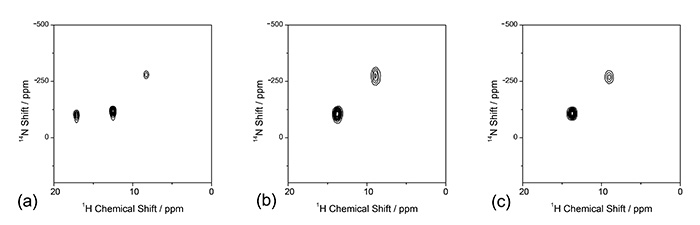
พื้นที่ 1ชม/{14N} สเปกตรัม NMR ของ (a) L-histidine·HCl·H2O, (b) L-histidine (orthorhombic) และ (c) L-histidine (monoclinic) สเปกตรัม (a) วัดที่อัตรา MAS 90 kHz ด้วยโพรบ HXMAS 0.75 มม. (JEOL RESONANCE Inc. ประเทศญี่ปุ่น) แปดสแกนสำหรับแต่ละt1 คาบสะสมด้วย (a) 64 และ (b)/(c) 32 t1 เพิ่มขึ้น ไม่ 1ชม-14ใช้ N recoupling ในช่วงเวลาผสม รูปภาพนี้ทำซ้ำจากการอ้างอิง 7
วิธีการใหม่ที่พัฒนาขึ้นสำหรับ Crystalline Polymorphs
แม้ว่าไนโตรเจนจะมีความสำคัญในด้านเคมี เภสัชศาสตร์ วัสดุศาสตร์ ฯลฯ แต่ NMR ของไนโตรเจนก็ค่อนข้างจำกัด นี่เป็นเพียงเพราะความไวต่ำของ 15N NMR เนื่องจากความอุดมสมบูรณ์ต่ำของ 15ยังไม่มีข้อความ (0.4%) แม้ว่า 15นิยมใช้ N เนื่องจากเลขควอนตัมสปินของ I = 1/2 ส่วนไอโซโทปอีกตัวของ 14N ยังเป็นนิวเคลียสแอคทีฟ NMR ด้วยความอุดมสมบูรณ์สูง 99% ที่น่าพอใจ หมายเลขควอนตัมสปินจำนวนเต็ม (I = 1) และการมีอยู่ของคัปปลิ้งควอดรูโพลาร์ขัดขวางการใช้งานของ 14เอ็น เอ็นเอ็มอาร์ เพื่อเอาชนะปัญหาเหล่านี้ เราได้พัฒนา 1ชม-{14N} การวัดความเชื่อมโยงหลายควอนตัมเฮเทอโรนิวเคลียร์ (HMQC) ที่สภาวะ MAS ที่เร็วมาก [8] วิธีนี้ช่วยให้สามารถตรวจวัดปริมาณงานสูงด้วยตัวอย่างที่มีมวลจำกัดน้อยกว่า 1 มก. เนื่องจากความไวสูง วิธีการนี้สามารถขยายออกเป็นสามมิติได้สำหรับ 14N/1เอช ดีคิว/1การทดลองสหสัมพันธ์ H SQ[9]. นอกจากนี้ วิธีการนี้ยังสำรวจการสังเกตของ 35Cl ที่มักพบในเกลือยา [10]
การกำหนดสัญญาณช่วยในการตีความสเปกตรัม NMR ตามที่กล่าวไว้ข้างต้นในรูปที่ 6 ในขณะที่สหสัมพันธ์โฮโม/เฮเทอโรนิวเคลียร์สหสัมพันธ์สองมิติช่วยได้มากในการกำหนดสัญญาณผ่านคอนเนกทีฟคอนเนกทีฟแบบสองสปิน การทดลองสามมิติจะให้การกำหนดที่ชัดเจนกว่ามาก ด้วยเหตุนี้เราจึงพัฒนา 13C/1เอช ดีคิว/1ความสัมพันธ์ H SQ เพื่อเปิดเผยท้องถิ่น 1H-1เครือข่าย H สปินในบริเวณใกล้เคียงของ 13ค [11]. การกำหนดที่สมบูรณ์ได้มาจากสเปกตรัมสามมิติเดียวที่มีตัวอย่าง 1 มก. ที่ความอุดมสมบูรณ์ตามธรรมชาติ
เกลือ/คริสตัล/ต่อเนื่อง[12]
ตามที่กล่าวไว้ข้างต้น การระบุเกลือ/คริสตัล/ความต่อเนื่องยังคงเป็นปัญหาใหญ่ในการใช้งานทางเภสัชกรรมเนื่องจากขาดความสามารถในการระบุตำแหน่งไฮโดรเจนใน XRD ความแตกต่างระหว่างสามคลาสนี้สามารถตีความได้ว่าเป็นระยะห่างที่แตกต่างกันระหว่างไฮโดรเจนและไนโตรเจน (รูปที่ 8) ดังนั้นขนาดของ 1H-15ไม่มีอันตรกิริยาสองขั้วซึ่งมีสัดส่วนผกผันกับลูกบาศก์ของระยะห่างระหว่างนิวเคลียร์ ควรให้คำตอบที่ชัดเจนแก่เกลือ/ผลึกโคคริสตัล/ความต่อเนื่อง
ในที่นี้ เราขอเสนอวิธีการรวมกันระหว่าง SCXRD และ ssNMR ในขณะที่ SCXRD กำหนดโครงสร้างผลึกทั่วโลก ssNMR จะให้ระยะทางระหว่างนิวเคลียร์ในพื้นที่ ด้วยการรวมข้อมูลทั้งสองประเภทนี้เข้าด้วยกัน ทำให้เกิดความเข้าใจอย่างราบรื่นของโครงสร้างผลึกได้ ในการสาธิต ก่อนอื่น เราสังเคราะห์ระบบหลายองค์ประกอบสี่แบบจำลองที่แสดงในรูปที่ 9 โครงสร้างผลึกถูกกำหนดโดย SCXRD ผลลัพธ์แสดงให้เห็นอย่างชัดเจนว่ามีการสัมผัสระหว่างโมเลกุลระหว่าง N และ OH ตามที่คาดไว้อย่างชัดเจน (รูปที่ 10) คำถามคือมันเป็นเกลือ/คริสตัล/ต่อเนื่อง เพื่อตอบคำถามนี้ เราพยายามกำหนดตำแหน่งไฮโดรเจนโดย SCXRD อย่างไรก็ตาม มันให้ค่าที่ขึ้นกับเครื่องจักร ส่งผลให้ตำแหน่งไม่น่าเชื่อถือ ตามโครงสร้างผลึกที่กำหนดโดย SCXRD แสดงให้เห็นอย่างชัดเจน มีการมีเพศสัมพันธ์ 1H/15N ระหว่างโมเลกุล ดิ 1H/15ระยะทาง N ดังนั้นความแรงของการมีเพศสัมพันธ์ระหว่าง 1H และ 15N ควรให้คำตอบสำหรับปัญหาเกลือ/คริสตัล/ความต่อเนื่อง ตัวอย่างเช่น, 1H/15ระยะทาง N ใน SA2 ถูกกำหนดเป็น 1.25 Å (รูปที่ 10) ด้วยระยะห่างระหว่างไนโตรเจนกับออกซิเจน 2.54 Å ซึ่งกำหนดโดย SCXRD เราสามารถสรุปได้ว่า SA2 เป็นคอนตินิวอัมเนื่องจากไฮโดรเจนตั้งอยู่ตรงกลางของออกซิเจนและไนโตรเจน ควรสังเกตว่า SA2 ประกอบด้วยกรดและเบสแก่โดยมีค่า ΔpKa มากกว่า 3 ผลลัพธ์นี้เน้นให้เห็นถึงความสำคัญของการวัด SCXRD/ssNMR เพื่อระบุเกลือ/คริสตัล/ความต่อเนื่องแม้สำหรับระบบที่มี ΔpKa มาก โครงสร้างและระยะห่างระหว่างนิวเคลียร์ของระบบอีกสามระบบได้รับการกำหนดสำเร็จแล้ว (รูปที่ 10) คอขวดของวิธีนี้เป็นเวลาทดลองสำหรับ 1H-15N การวัดระยะทาง นอกจากความอุดมสมบูรณ์ทางธรรมชาติที่ต่ำแล้วของ 15N และเล็ก 1H-15N couplings ตัวอย่างยาเหล่านี้มักจะแสดงยาวมาก 1HT1 เวลาพักผ่อน นอกจากนี้ ความต้องการ MAS ที่รวดเร็วจะช่วยลดปริมาณตัวอย่าง ส่งผลให้ความไวลดลงอีก เราได้พัฒนาวิธีการปรับปรุงปริมาณงานตามที่กล่าวไว้ในส่วนต่อไปนี้ การวัดแต่ละครั้งยังต้องใช้เวลา 4-5 วัน เราเห็นด้วยกับข้อเท็จจริงของปริมาณงานที่จำกัด อย่างไรก็ตาม เราเชื่อว่าวิธีนี้ค่อนข้างมีประโยชน์ เนื่องจากไม่มีวิธีอื่นให้คำตอบที่ชัดเจน
การวัด NMR ทั้งหมดดำเนินการด้วย JNM-ECA700II NMR spectrometer (JEOL RESONANCE Inc.) โดยใช้โพรบ MAS เร็วเรโซแนนซ์คู่ 1 มม. (JEOL RESONANCE Inc.) ที่ 16.4 ต.
Fig.8
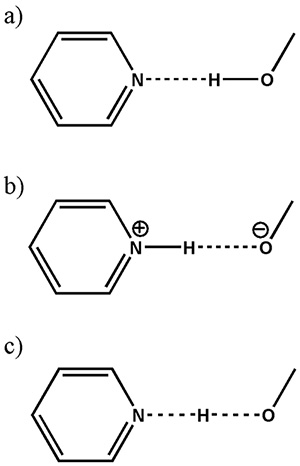
แผนผังแสดง (a) cocrystal (b) เกลือและ (c) คอนตินิวอัม (โดยที่ตำแหน่ง H-atom ใช้ร่วมกันระหว่างอะตอมหนักสองอะตอม) ใน O ทั่วไป...H...ไม่มีปฏิสัมพันธ์ ตัวเลขนี้ทำซ้ำจากการอ้างอิง 12
Fig.9
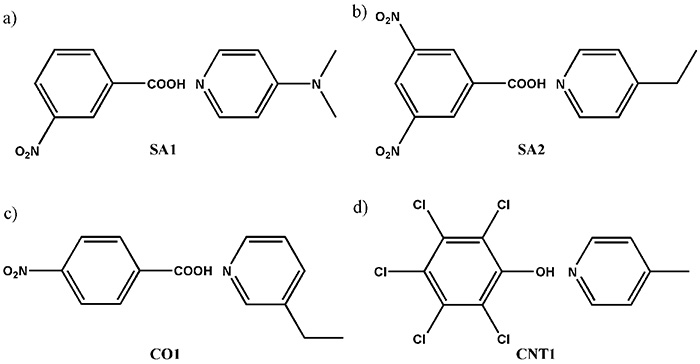
การแสดงแผนผังของสารประกอบที่ใช้ในการศึกษานี้ ซึ่งแสดง (a) SA1 (3-กรดไนโตรเบนโซอิกและ N,N-ไดเมไทไพริดิน-4-เอมีน), (b) SA2 (3,5-ไดไนโตรเบนโซอิกแอซิดและ 4-เอทิลไพริดีน), (c) CO1 (4-กรดไนโตรเบนโซอิกและ 3-เอทิลไพริดีน) และ (ง) CNT1 (เพนตาคลอโรฟีนอลและ 4-เมทิลไพริดีน) ตัวเลขนี้ทำซ้ำจากการอ้างอิง 12
Fig.10
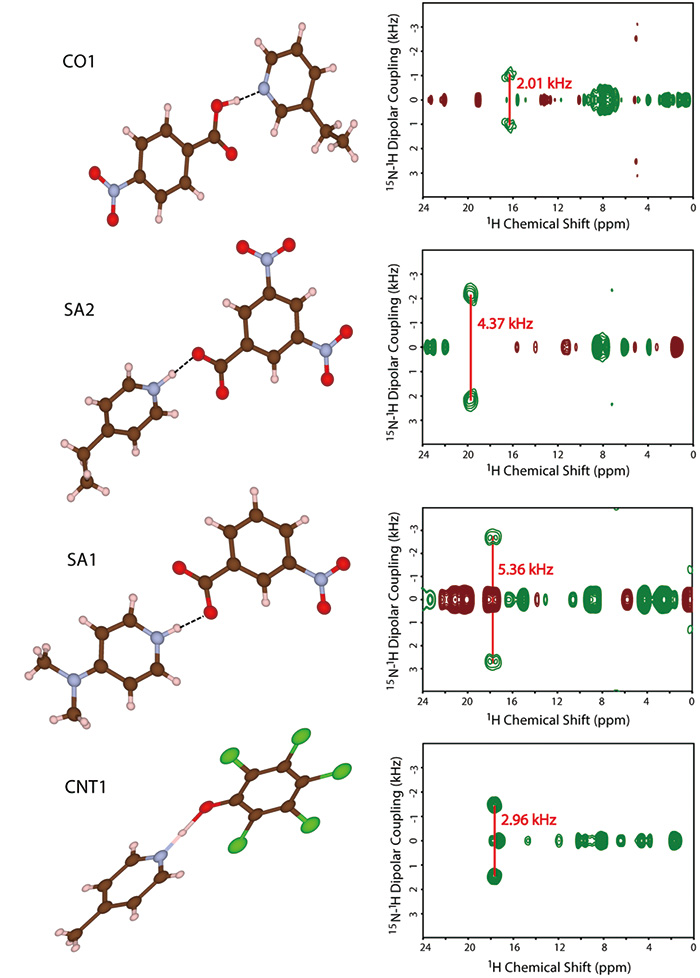
โครงสร้างโมเลกุลและสเปกตรัม invCP-VC สองมิติ (15N-1H ไดโพลาร์คัปปลิ้งกับ 1H การเปลี่ยนแปลงทางเคมี) ของ SA1, SA2, CO1 และ CNT1 รูปภาพนี้ทำซ้ำจากข้อมูลอ้างอิง 12
วิธีการใหม่ที่พัฒนาขึ้นสำหรับเกลือ/Cocrystal/Continuum
ขนาดของ 1H/15ไม่ควรวัดค่าคัปปลิ้งแบบไดโพลาร์อย่างแม่นยำ อย่างไรก็ตามไม่ใช่งานตรงไปตรงมาเพราะ 1) ความอุดมสมบูรณ์ต่ำ 15N (0.4%), 2) อัตราส่วนไจโรแม่เหล็กขนาดเล็ก (1/10 ของ 1H) และ 3) มากมาย 1นิวเคลียส H ที่ไม่ยึดติดกับ 15N ทำให้เกิดความไวต่ำ ไดโพลาร์คัปปลิ้งขนาดเล็ก (1-7 kHz) และ 1H resonances ตามลำดับ ที่สำคัญกว่านั้น วิธีก่อนหน้านี้มักจะแสดง 1H/15ไม่มีไดโพลาร์คัปปลิ้งซึ่งขึ้นอยู่กับเงื่อนไขการทดลอง ทำให้ระยะทางไม่น่าเชื่อถือ เพื่อเอาชนะปัญหาเหล่านี้ เราได้แนะนำ CP ที่ตรวจพบผกผันด้วยวิธีการติดต่อแบบแปรผัน (inv CP-VC) ที่ MAS ที่รวดเร็ว [13] ประการแรก วิธีการนี้ให้การแยกขั้วแบบขั้วที่ชัดเจนซึ่งไม่ขึ้นกับเงื่อนไขการทดลอง [14] ที่จริงแล้ว ปัจจัยการสเกลของวิธี inv CP-VC นั้นขึ้นอยู่กับความแรงของสนามคลื่นความถี่วิทยุเป็นส่วนใหญ่ อย่างไรก็ตาม สัญญาณจากพื้นที่ด้วย B1 ความไม่เท่าเทียมกันจะกระจัดกระจายไปทั่วช่วงสเปกตรัมกว้าง ทำให้มองไม่เห็นสัญญาณเหล่านี้ ดังนั้นสัญญาณจาก B . ที่เป็นเนื้อเดียวกัน1 ฟิลด์จะถูกเลือกสังเกต การเพิ่มประสิทธิภาพความไวโดย 1การตรวจจับ H ใน inv CP-VC บรรเทาความไวต่ำเนื่องจากปริมาณตัวอย่างและปริมาณตัวอย่างเหลือน้อย จากการทดลองพบว่า inv CP-VC สามารถตรวจสอบ a 1H/15N คัปปลิ้ง 2 kHz inv CP-VC ทำงานเป็นตัวกรองของ 1H resonances ให้การสังเกตแบบเลือกของ 1H ใกล้กับ 15N. เพื่อหลีกเลี่ยงความซับซ้อนของการสะท้อนที่ทับซ้อนกันระหว่าง 1เอชเอส นอกจากนี้ inv CP-VC ยังปูทางให้วิเคราะห์ตัวอย่างที่มีมวลจำกัดซึ่งน้อยกว่า 1 มก.
ต้องใส่การหน่วงเวลาซ้ำระหว่างการสแกนที่ต่อเนื่องกันในการวัด NMR เพื่อให้ระบบหมุนกลับเข้าสู่สภาวะสมดุลทางความร้อนก่อนเริ่มการวัด NMR เนื่องจากความล่าช้าในการทำซ้ำควรเป็นคำสั่งของT1 เวลาพักผ่อน ซึ่งโดยทั่วไปแล้วจะนานกว่าการทดลองอื่นๆ T1 เวลาพักผ่อนเป็นปัจจัยครอบงำเวลาทดลองใน NMR ในการทดลอง CP-VC inv การสะกดจิตเริ่มต้นจาก 1เอช ดังนั้น 1HT1 เป็นสิ่งสำคัญ อย่างไรก็ตาม APIs ที่มีน้ำหนักโมเลกุลต่ำที่เป็นผลึกมักจะมีความยาวมาก 1HT1 เวลาพักผ่อนตั้งแต่สิบถึงหลายร้อยวินาที ลดปริมาณงานลงอย่างมาก ในอัตรา MAS ที่รวดเร็ว ปัญหานี้รุนแรงกว่าเพราะ 1H-1H spin diffusion ถูกระงับ ส่งผลให้นานขึ้น 1HT1 เวลาพักผ่อน เนื่องจากโปรตอน NH ซึ่งเราสนใจ ถูกแยกออกจากกันในเชิงพื้นที่และเชิงสเปกตรัมจาก 1Hs อื่นๆ จึงช้ามาก 1H-1การแพร่กระจายของสปิน H ขัดขวาง 1การทำให้เป็นแม่เหล็ก H จากการฟื้นตัวสู่สมดุลทางความร้อน ส่งผลให้ช้าลง 1HT1 เวลาพักผ่อนของโปรตอน NH เมื่อเทียบกับส่วนที่เหลือของ 1เอชเอส เพื่อเอาชนะความยากลำบากนี้ เราได้ใช้ลำดับการควบรวมใหม่ที่ใช้คลื่นความถี่วิทยุ (RFDR) บน 1H ระหว่างหน่วงเวลาซ้ำ [15] สิ่งนี้ช่วยเพิ่ม 1H-1H สปินกระจายนำแม่เหล็กจากการผ่อนคลายอย่างรวดเร็ว 1โปรตอน H ถึง NH เนื่องจากกลไกการคลายตัวของโปรตอนที่คลายตัวอย่างรวดเร็วถูกนำมาใช้หลายครั้ง ไม่เพียงแต่ โปรตอน NH แต่ยังปรับปรุงความไวโดยรวมได้อีกด้วย เรายังปรับรอบเฟสให้เหมาะสมในลำดับ RFDR ที่เหมาะสมกับ 1เอช มิกซ์ [16, 17].
สรุป
ทั้ง TEM และ NMR ได้รับการปรับปรุงอย่างต่อเนื่องแม้ในขณะนี้ แม้ว่าจะมีการเปิดตัวเมื่อกว่า 70 ปีที่แล้วก็ตาม กล้องความไวสูงที่เพิ่งเปิดตัวใน TEM เปิดทางสู่แอปพลิเคชันใหม่ใน cryo TEM เพื่อกำหนดโครงสร้างโปรตีนโดยใช้วิธีการวิเคราะห์อนุภาคเดี่ยว การเพิ่มประสิทธิภาพของความไวนั้นมีประโยชน์ไม่เพียง แต่สำหรับโปรตีนเท่านั้น แต่ยังรวมถึงตัวอย่างที่ไวต่อลำแสง ซึ่งรวมถึง API ที่มีน้ำหนักโมเลกุลต่ำ มีการตรวจพบการระเบิดครั้งใหญ่อีกครั้งในเทคโนโลยี MAS ที่รวดเร็วของ ssNMR ซึ่งช่วยให้ 1H NMR แม้กระทั่งของแข็งแข็ง การพัฒนาใหม่เหล่านี้ไม่เพียงแต่ให้ข้อมูลใหม่ที่ไม่สามารถเข้าถึงได้ก่อนหน้านี้ แต่ยังปรับปรุงปริมาณงาน ซึ่งเป็นหนึ่งในปัจจัยสำคัญสำหรับการใช้งานในวงกว้าง นอกจากนี้ การใช้วิธีการวิเคราะห์ต่างๆ ที่แตกต่างกันเป็นสิ่งสำคัญมากซึ่งเป็นประโยชน์ต่อกันและกัน ชุดค่าผสมที่เหมาะสมให้ข้อมูลที่เป็นประโยชน์พร้อมปริมาณงานสูง อันที่จริง JEOL Ltd. ยังผลักดันกลยุทธ์ YOKOGUSHI เพื่อนำเสนออุปกรณ์ที่ผสมผสานกันอย่างลงตัว
ในบทความนี้ เรารวม XRD, ED และ ssNMR เพื่อแก้ปัญหาเชิงโครงสร้างในสาขาวิทยาศาสตร์เภสัชกรรม ซึ่งรวมถึงผลึกโพลีมอร์ฟและปัญหาเกลือ/คริสตัล/ต่อเนื่อง สำหรับปัญหา crystalline polymorphs เราสาธิตวิธีการผสมผสานของ ED และ 1H MAS NMR แบบเร็วเพื่อระบุรูปแบบผลึก ซึ่งเป็นวิธีการเสริมสำหรับ PXRD และ 13ซี ซีพีเอ็มเอส. ED ช่วยให้สามารถกำหนดรูปแบบผลึกได้ตั้งแต่ผลึกเดี่ยวขนาดนาโนถึงไมโคร ในทางกลับกัน, 1H fast MAS สามารถแยกแยะรูปแบบผลึกที่มีโครงสร้างโมเลกุลคล้ายคลึงกัน นอกจากนี้ MAS ที่รวดเร็วยังช่วยให้ 1H/14ไม่มีความสัมพันธ์ ทำให้ตำแหน่งโปรตอนใกล้กับนิวเคลียสไนโตรเจน เพื่อระบุเกลือ/คริสตัล/ต่อเนื่อง ได้มีการแนะนำวิธีการแบบผสมผสานของ SCXRD และ ssNMR ที่อัตรา MAS ที่เร็วมาก แม้ว่า SCXRD จะให้โครงสร้างโมเลกุลทั่วโลก แต่ก็ล้มเหลวในการระบุตำแหน่งของโปรตอนซึ่งมีความสำคัญต่อปัญหาเกลือ/ผลึก/ความต่อเนื่อง ในทางกลับกัน ssNMR ให้ความแม่นยำ 1H-15ระยะทาง N แม้ว่าโครงสร้างโลกจะแทบจะไม่ได้ แนวทางนี้ให้ความเข้าใจอย่างราบรื่นของโครงสร้างโมเลกุลตั้งแต่โครงสร้างผลึกไปจนถึงพันธะไฮโดรเจน เพื่อตอบปัญหาเกลือ/คริสตัล/ต่อเนื่อง การก่อตัวของความต่อเนื่องในระบบหลายองค์ประกอบด้วย ΔpKa > 3 เน้นถึงความสำคัญของการตรวจสอบอย่างละเอียดโดยใช้ SCXRD และ ssNMR
กิตติกรรมประกาศ
งานทั้งหมดที่นำเสนอนี้ดำเนินการร่วมกับสมาชิกในกลุ่มของเราที่ห้องปฏิบัติการการทำงานร่วมกันของ RIKEN CLST-JEOL ฉันขอขอบคุณสมาชิกทุกคนในกลุ่มและเพื่อนร่วมงานของเราที่ JEOL Ltd. และ JEOL RESONANCE Inc. สำหรับการสนับสนุนที่ดี ฉันยังต้องการรับทราบเพื่อนๆ ของเราที่สถาบันวิทยาศาสตร์อินเดียที่บังกาลอร์, AMES lab, Kyoto University, Tokyo University of Agriculture and Technology, University of Warwick, University of Lille, University of Michigan สำหรับความร่วมมือที่ประสบผลสำเร็จ
อ้างอิง
- อาร์เค แฮร์ริส เจ. ฟาร์ม. Pharmacol. 59 (2007) 225–239
- M. Geppi, G. Mollica, S. Borsacchi, CA Veracini, แอปพลิเค สเปกตรัม Rev. 43 (2008) 202–302
- เอฟจี วอกต์, แพทย์ในอนาคต เคมี. 2 (2010) 915–921
- Y. Nishiyama*, Fast Magic-Angle Sample Spinning Solid-State NMR ที่ 60-100 kHz สำหรับตัวอย่างที่อุดมสมบูรณ์ตามธรรมชาติ, โซลิดสเตตนิวเคลียร์แม่เหล็กเรโซแนนซ์, 78 (2016) 24-36. ดอย: 10. 1016/จ. ssnmr 2016. 06. 002.
- Y. Nishiyama*, Solid-state NMR ภายใต้อัตรา MAS ที่เร็วมากที่ 40 ‒ 120 kHz, ในแนวทางการทดลองของ NMR Spectroscopy ‐ Methodology and Application to Life Science and Materials Science, Springer (2017)
- T. Kobayashi, Y. Nishiyama*, M. Pruski*, Heteronuclear correlation spectroscopy with inverse detection ในวิธีการสมัยใหม่ใน Solid-State NMR: A Practitioner's Guide, Royal Society of Chemistry (2018)
- T. Oikawa, M. Okumura, T. Kimura, Y. Nishiyama*, Solid-state NMR พบกับการเลี้ยวเบนของอิเล็กตรอน: การหาค่าพอลิมอร์ฟของผลึกของตัวอย่างไมโครคริสตัลไลน์ขนาดเล็กของ rganic, แอคต้าคริส. C73 (2017) 219‒228. ดอย: 10. 1107/S2053229617003084.
- วาย. นิชิยามะ*, วาย. เอนโด, ที. เนโมโตะ, เอช. อุสึมิ, เค. ยามาอุจิ,
คุณเป็นผู้เชี่ยวชาญทางการแพทย์หรือบุคลากรที่เกี่ยวข้องกับการรักษาพยาบาลหรือไม่?
ไม่
โปรดทราบว่าหน้าเหล่านี้ไม่ได้มีวัตถุประสงค์เพื่อให้ข้อมูลเกี่ยวกับผลิตภัณฑ์แก่ประชาชนทั่วไป
