การพัฒนาทางเทคนิคของอิเล็กตรอน Cryomicroscopy และการมีส่วนร่วมในวิทยาศาสตร์เพื่อชีวิต
JEOL NEWS ฉบับที่ 53 No.3
เคอิจิ นัมบะ และ ทาคายูกิ คาโตะ
บัณฑิตวิทยาลัยชีววิทยาศาสตร์ฟรอนเทียร์ มหาวิทยาลัยโอซาก้า
โครงสร้างสามมิติของโมเลกุลขนาดใหญ่ทางชีววิทยาและสารเชิงซ้อนของพวกมันเป็นข้อมูลพื้นฐาน ไม่เพียงแต่สำหรับวิทยาศาสตร์เพื่อชีวิต แต่ยังสำหรับวิทยาศาสตร์การแพทย์และการออกแบบยาด้วย Electron cryomicroscopy กำลังดึงดูดความสนใจเป็นอย่างมากในฐานะเครื่องมืออันทรงพลังสำหรับการวิเคราะห์โครงสร้างที่มีความละเอียดสูง นอกเหนือจาก X-ray crystallography และ NMR ที่ใช้เป็นเทคนิคพื้นฐาน โครงสร้างของสารชีวโมเลกุลสามารถถูกสร้างภาพและวิเคราะห์ที่ความละเอียดระดับอะตอมในสถานะดั้งเดิมได้อย่างไร ทั้งที่พวกมันได้รับความเสียหายอย่างง่ายดายจากระดับการฉายรังสีอิเล็กตรอนที่ค่อนข้างต่ำ บทความนี้จะอธิบายประวัติศาสตร์และสถานะปัจจุบันของการพัฒนาเทคโนโลยีของเราเองในด้านอิเล็กตรอน cryomicroscopy และความคาดหวังและโอกาสในอนาคตโดยการพัฒนาต่อไป
บทนำ
รางวัลโนเบลสาขาเคมีประจำปี 2017 มอบให้กับ Jacques Dubochet (มหาวิทยาลัยโลซานน์ ประเทศสวิตเซอร์แลนด์), Joachim Frank (มหาวิทยาลัยโคลัมเบีย ประเทศสหรัฐอเมริกา) และ Richard Henderson (MRC Laboratory of Molecular Biology, UK) สำหรับผลงานบุกเบิกในการพัฒนาอิเล็กตรอน cryomicroscopy และการวิเคราะห์ภาพสำหรับการวิเคราะห์โครงสร้างของโมเลกุลขนาดใหญ่ทางชีววิทยา เช่น โปรตีนและกรดนิวคลีอิก โครงสร้างสามมิติ (3D) ของชีวโมเลกุลเป็นข้อมูลพื้นฐานและสำคัญไม่เพียงแต่สำหรับวิทยาศาสตร์เพื่อชีวิตแต่สำหรับวิทยาศาสตร์การแพทย์และการออกแบบยาด้วย และอิเล็กตรอน cryocroscopy (cryoEM) ได้กลายเป็นเครื่องมือที่มีประสิทธิภาพสำหรับการวิเคราะห์โครงสร้างที่มีความละเอียดสูงในอดีต หลายปีที่ผ่านมาและขณะนี้ได้กำหนดจุดยืนให้เป็นหนึ่งในเทคนิคที่จำเป็นสำหรับการวิเคราะห์โครงสร้าง นอกเหนือไปจากการตกผลึกด้วยเอ็กซ์เรย์และ NMR แบบเดิม Electron cryomicroscopy ได้รับความสนใจอย่างมากเนื่องจากสามารถบรรลุความละเอียดใกล้อะตอมในการวิเคราะห์โครงสร้างด้วยตัวอย่างสารละลายจำนวนเล็กน้อยเท่านั้น โดยมีขนาดเล็กเพียงไม่กี่สิบไมโครกรัมโดยไม่จำเป็นต้องตกผลึก รางวัลโนเบลได้รับรางวัลเพื่อยกย่องการมีส่วนร่วมของนักวิจัยสามคนข้างต้นในฐานะผู้ก่อตั้งเทคโนโลยีนี้ ในที่นี้ เราอธิบายแนวคิดของอิเล็กตรอน cryomicroscopy และการวิเคราะห์ภาพเป็นเทคนิคสำหรับชีววิทยาโครงสร้าง ประวัติและสถานะปัจจุบันของการพัฒนาเทคโนโลยีของเราเอง และศักยภาพในอนาคตของเทคนิคนี้สำหรับชีวิตและวิทยาศาสตร์การแพทย์ผ่านการพัฒนาต่อไป
การวิเคราะห์โครงสร้างของโมเลกุลขนาดใหญ่ทางชีววิทยาโดยอิเล็กตรอน cryomicroscopy
กลไกพื้นฐานที่ขับเคลื่อนและสนับสนุนกิจกรรมทางชีววิทยานั้นมีการใช้ร่วมกันอย่างสูงในสิ่งมีชีวิตที่หลากหลาย ตั้งแต่จุลินทรีย์ เช่น แบคทีเรียและยีสต์ ไปจนถึงสิ่งมีชีวิตหลายเซลล์ เช่น สัตว์และพืช รวมถึงมนุษย์ที่มีการทำงานของสมองในระดับสูง หน้าที่ทั้งหมดเหล่านี้พิจารณาจากโครงสร้างของโปรตีนและกรดนิวคลีอิกที่มีการจัดเรียง 3 มิติของอะตอมจำนวนมาก ตั้งแต่ไม่กี่พันถึงหลายหมื่น นอกจากนี้ โครงสร้างไม่แข็งเหมือนวัสดุจำนวนมากของโลหะและเซรามิก แต่มีไดนามิกและยืดหยุ่นสูง และได้รับการออกแบบมาให้ทำงานโดยใช้ความผันผวนของความร้อนอย่างแข็งขัน หนึ่งในความท้าทายที่สำคัญในวิทยาศาสตร์เพื่อชีวิตคือการอธิบายกลไกที่กำหนดและแสดงหน้าที่เหล่านี้ และจำเป็นต้องดูโครงสร้าง 3 มิติของโมเลกุลขนาดใหญ่จำนวนมากในสภาวะต่างๆ ที่เกี่ยวข้องกับหน้าที่ทางชีววิทยาต่างๆ จำนวนของโครงสร้าง 3 มิติที่เราต้องแก้ไขจะมีตั้งแต่ไม่กี่แสนถึงสองสามล้าน
คุณลักษณะที่มีประสิทธิภาพของ cryoEM โดยเฉพาะอย่างยิ่งการวิเคราะห์ภาพอนุภาคเดี่ยว คือ ไม่จำเป็นต้องมีการตกผลึกของตัวอย่างซึ่งจำเป็นสำหรับผลึกศาสตร์เอ็กซ์เรย์ และแทบไม่มีขีดจำกัดบนของขนาดของสารเชิงซ้อนโมเลกุลที่แตกต่างจาก NMR อย่างไรก็ตาม เนื่องจากพันธะระหว่างอะตอมส่วนใหญ่ที่รักษาโครงสร้าง 3 มิติของพวกมันนั้นเป็นพันธะที่ไม่ใช่โควาเลนต์ เช่น พันธะไฮโดรเจน สะพานเกลือ และการสัมผัสของแวนเดอร์วาลส์ โครงสร้างเหล่านี้จึงไวต่อความเสียหายจากการฉายรังสีของลำแสงอิเล็กตรอนมาก มากกว่าโลหะ เซรามิกส์ และเซมิคอนดักเตอร์ ดังนั้น ในการบันทึกภาพความละเอียดสูงของโมเลกุลขนาดใหญ่ทางชีววิทยาในสภาพดั้งเดิมโดยไม่มีความเสียหายมากนัก จึงจำเป็นต้องฝังพวกมันไว้ในฟิล์มบางที่เป็นน้ำแข็งอสัณฐานโดยการแช่แข็งสารละลายในน้ำอย่างรวดเร็ว และบันทึกภาพด้วยอิเล็กตรอนไครโอมิคสโคปแบบส่งผ่าน (cryoTEM) ขั้นของชิ้นงานทดสอบที่ระบายความร้อนด้วยฮีเลียมเหลวหรือไนโตรเจนเหลวให้มีอุณหภูมิต่ำพอที่จะป้องกันไม่ให้น้ำแข็งในน้ำวุ้นตาเปลี่ยนสถานะเป็นผลึก แม้ในอุณหภูมิที่ต่ำเช่นนี้ ปริมาณอิเล็กตรอนที่สามารถฉายรังสีได้โดยไม่ทำลายโครงสร้างระดับอะตอมมากนักก็จำกัดอยู่ที่ 20 ถึง 30 e-/Å2 และด้วยเหตุนี้ รูปภาพ cryoEM มีแนวโน้มที่จะต่ำมากเนื่องจากสัญญาณรบกวนทางสถิติที่แท้จริง ซึ่งเกิดจากการตรวจพบอิเล็กตรอนจำนวนค่อนข้างน้อยในแต่ละพิกเซลของเครื่องตรวจจับภาพ และสัญญาณรบกวนของรถม้าซึ่งมีสาเหตุมาจากการกระจายขนาดใหญ่ ของระดับสัญญาณของการตรวจจับอิเล็กตรอนแต่ละตัว เนื่องจากภาพโมเลกุลแต่ละภาพที่บันทึกโดย cryoTEM เป็นภาพฉายภาพ 2 มิติของโมเลกุลที่ฝังอยู่ในฟิล์มน้ำแข็งอสัณฐานในทิศทางต่างๆ จึงจำเป็นต้องรวบรวมภาพจำนวนมากที่เพียงพอที่จะครอบคลุมการวางแนวที่แตกต่างกันด้วยการแจกแจงที่เท่ากันเพื่อสร้างใหม่ ภาพ 3 มิติที่ความละเอียดสูง ดังนั้นจึงจำเป็นอย่างยิ่งที่จะต้องรวบรวมภาพระดับโมเลกุลให้มากที่สุดเท่าที่จะมากได้ จำแนกพวกมันในแต่ละทิศทางของการฉายภาพ และรับภาพเฉลี่ยสำหรับแต่ละทิศทางโดยการจัดตำแหน่งและการวางแนวของภาพโมเลกุลเพื่อเพิ่มระดับสัญญาณในขณะที่ลดสัญญาณรบกวน . ขั้นตอนนี้เรียกว่า ค่าเฉลี่ยคลาส 2D จากนั้น จะกำหนดความสัมพันธ์แบบสัมพัทธ์ระหว่างภาพที่เฉลี่ยในคลาส 2D ในการวางแนวของการฉายภาพ และในที่สุด ภาพ 3 มิติของโมเลกุลก็สามารถสร้างใหม่ได้ (รูปที่ 1) เพื่อให้ได้การวิเคราะห์โครงสร้างที่มีความละเอียดสูง สิ่งสำคัญคือต้องใช้ cryoTEM และเครื่องตรวจจับภาพที่สามารถรวบรวมภาพ cryoEM คุณภาพสูงและความละเอียดสูงได้อย่างมีประสิทธิภาพ โปรแกรมวิเคราะห์ภาพที่มีความแม่นยำสูงและคอมพิวเตอร์ความเร็วสูงก็จำเป็นเช่นกัน เราจะอธิบายประวัติของการพัฒนาระบบ cryoTEM ของเราเองเพื่อแก้ปัญหาดังกล่าวและความสำเร็จบางส่วนโดยใช้สิ่งเหล่านี้
รูปที่ 1 แผนผังอธิบายกระบวนการวิเคราะห์ภาพอนุภาคเดี่ยว
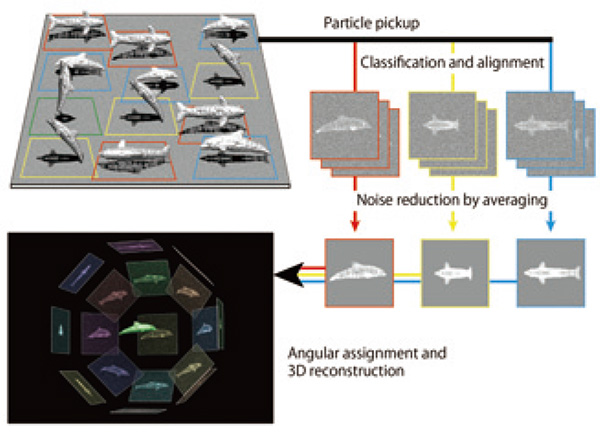
โลมาเป็นตัวแทนของชีวโมเลกุลที่ฝังอยู่ในฟิล์มน้ำแข็งบางๆ ในทิศทางต่างๆ ภาพ CryoEM สอดคล้องกับการฉายภาพ 2 มิติที่มีระดับสัญญาณรบกวนสูง หลังจากที่ S/N เพิ่มขึ้นอย่างมากโดยผ่านการจำแนกประเภท 2D และค่าเฉลี่ยของการฉายภาพ 2D จำนวนมาก ภาพ 3D จะถูกสร้างขึ้นใหม่
ความก้าวหน้าใน cryoTEM เครื่องตรวจจับภาพและวิธีการรวบรวมและวิเคราะห์ข้อมูล
ปืนอิเล็กตรอนปล่อยสนาม
ผู้บุกเบิกวงการ cryoEM ในญี่ปุ่นคือ Yoshinori Fujiyoshi (ศาสตราจารย์เยี่ยมมหาวิทยาลัยนาโกย่า) ในความร่วมมือกับ JEOL เขาได้ออกแบบและพัฒนา cryoTEM ด้วยขั้นตอนตัวอย่างที่ระบายความร้อนด้วยฮีเลียมเหลวที่เสถียรมากเป็นครั้งแรกในโลกเพื่อลดความเสียหายจากการฉายรังสีของลำแสงอิเล็กตรอนให้เหลือน้อยที่สุดเพื่อให้สามารถบันทึกภาพ cryoEM คุณภาพสูงของสิ่งมีชีวิตได้ โมเลกุลขนาดใหญ่ [1]. ฉันเริ่มร่วมมือกับเขาตั้งแต่ราวๆ ปี 1990 เพื่อเริ่มใช้อิเล็กตรอน cryomicroscopy สำหรับการวิเคราะห์โครงสร้างของเส้นใย flagellar ของแบคทีเรีย เพื่อทำความเข้าใจการประกอบและกลไกการขดลวดยิ่งยวด เราใช้การเลี้ยวเบนของเส้นใยเอกซเรย์และผลึกเอ็กซ์เรย์มาจนถึงสมัยนั้น เนื่องจากความละเอียดที่ทำได้โดยอิเล็กตรอน cryomicroscopy ค่อนข้างจำกัดในตอนนั้น แต่ฉันเข้าใจถึงศักยภาพของ cryoTEM กับขั้นตัวอย่างที่ระบายความร้อนด้วยฮีเลียมเหลวสำหรับโครงสร้างที่มีความละเอียดสูง การวิเคราะห์. เขาสอนเราเกี่ยวกับพื้นฐานของเทคนิค cryoEM ตั้งแต่การเตรียมกริด cryoEM ไปจนถึงการถ่ายภาพปริมาณขั้นต่ำของสารเชิงซ้อนโปรตีนที่ฝังด้วยน้ำแข็งที่แช่อยู่ในน้ำแข็ง จากนั้น ประมาณหนึ่งปีต่อมา ฉันได้รับงานจาก Tsuneharu Nitta ผู้อำนวยการ Central Research Laboratories ของ Panasonic (Matsushita Electric Industrial Co., Ltd. ในเวลานั้น) เพื่อเริ่มห้องปฏิบัติการของตัวเองในแผนกย่อยของห้องปฏิบัติการวิจัยเทคโนโลยีขั้นสูง ซึ่ง Panasonic กำลังวางแผนที่จะจัดตั้งในเมืองวิทยาศาสตร์ KeiHanNa ให้เป็นศูนย์ R&D ที่เน้นการวิจัยพื้นฐานแห่งใหม่ แผนกย่อยนี้เรียกว่าสถาบันระหว่างประเทศเพื่อการวิจัยขั้นสูง (IIAR) และฉันได้รับการสัญญาว่าจะมีเงินทุนสนับสนุนจำนวนมากสำหรับการพัฒนาอุปกรณ์ใหม่สำหรับการวิเคราะห์โครงสร้างด้วยรังสีเอกซ์และการส่องกล้องด้วยความเย็นด้วยอิเล็กตรอน ดังนั้นฉันจึงขอให้ Yoshinori Fujiyoshi เข้าร่วมสถาบัน Panasonic แห่งใหม่นี้เพื่อเริ่มต้น IIAR ร่วมกันในฐานะศูนย์วิจัยชีวฟิสิกส์เชิงโครงสร้างขั้นสูง เราขอให้ JEOL แนะนำอุปกรณ์ที่พัฒนาขึ้นใหม่ ซึ่งเป็นปืนอิเล็กตรอนแบบปล่อยสนามแม่เหล็กประเภท Schottky (Thermal FEG) ให้กับ cryoTEM ที่กล่าวถึงข้างต้นด้วยขั้นตอนของตัวอย่างที่ระบายความร้อนด้วยฮีเลียมเหลว นี่เป็น cryoTEM แรกสุดที่มี FEG และตั้งชื่อว่า JEM-3000SFF (Generation 3: G3) (รูปที่ 2) [1]. Panasonic ก่อตั้งสถาบัน KeiHanNa ใหม่ในปี 1994 และเราย้ายเข้าไปอยู่ในอาคารใหม่และตั้งห้องปฏิบัติการของเราด้วย cryoTEM ใหม่นี้ เราคาดว่าคุณภาพและความละเอียดของภาพ EM จะดีขึ้นอย่างเห็นได้ชัดโดยการเชื่อมโยงกันของลำอิเล็กตรอนในระดับสูงโดยการปล่อยมลพิษในสนาม การปรับปรุงนั้นน่าทึ่งจริง ๆ โดยแสดงสัญญาณความละเอียดสูงขึ้นมากในทุกอิมเมจ cryoEM ที่เรารวบรวม กลุ่ม Fujiyoshi มุ่งที่จะแก้ปัญหาโครงสร้างของโปรตีนเมมเบรน เช่น bacteriorhodopsin และ aquaporin ในผลึกสองมิติ และกลุ่มของเรามีจุดมุ่งหมายเพื่อวิเคราะห์โครงสร้างของส่วนประกอบที่เป็นเกลียวขนาดใหญ่ของโมเลกุลขนาดใหญ่ เช่น เส้นใยflagellar ของแบคทีเรีย เนื่องจากในสมัยนั้นมีเพียงฟิล์มถ่ายภาพเท่านั้นที่ใช้ได้ ประสิทธิภาพและปริมาณงานในการรวบรวมข้อมูลภาพคุณภาพสูงจึงต่ำมาก การวิเคราะห์โครงสร้างจึงใช้เวลานานกว่าหลายปีกว่าจะถึงความละเอียดใกล้อะตอม แต่เราก็ได้ผลลัพธ์ที่สร้างผลกระทบมากมายในช่วงกลางทศวรรษ 2000 ด้วยโครงสร้างความละเอียดของอะตอมของผลึก 2 มิติโปรตีนเมมเบรนและสารเชิงซ้อนระดับโมเลกุลขนาดใหญ่ [2-6 ]. การวิเคราะห์โครงสร้างเส้นใยแฟลเจลลาร์จากแบคทีเรียของเรามีความละเอียดใกล้เคียงกับ 4 Å โดยการวิเคราะห์ภาพอย่างระมัดระวังของรูปภาพ cryoEM คุณภาพสูงที่คัดเลือกมาอย่างดีของเส้นใยที่สอดคล้องกับโมเลกุลแฟลเจลลินเพียง 40,000 โมเลกุล และการพับกระดูกสันหลังของโพลีเปปไทด์และโซ่ด้านข้างขนาดใหญ่ได้รับการแก้ไขอย่างชัดเจน (รูปที่.
รูปที่ 2 ประวัติการพัฒนาของ cryoTEM ในกลุ่มของเรา

เทคโนโลยีและอุปกรณ์ที่รวมเข้าด้วยกันใหม่จะแสดงด้วยตัวอักษรสีแดง
รูปที่ 3 โครงสร้างโมเลกุลของเส้นใยแฟลเจลลาร์เปิดเผยโดยการวิเคราะห์ภาพ cryoEM
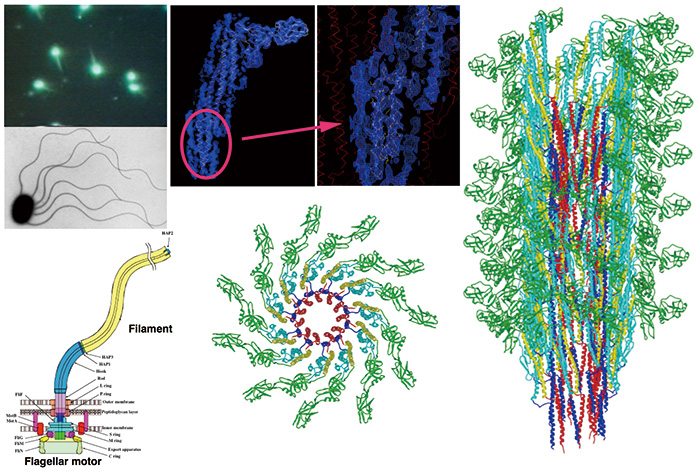
แฟลเจลลัมของแบคทีเรียเป็นออร์แกเนลล์เคลื่อนที่ด้วยมอเตอร์แบบหมุนและใบพัดใยแก้วแบบเกลียว ฟิลาเมนต์ flagellar เป็นการรวมตัวเป็นเกลียวขนาดใหญ่ที่ประกอบด้วยโมเลกุล flagellin นับหมื่นตัว ด้วยการใช้ JEM-3000SFF cryoTEM และฟิล์มถ่ายภาพเป็นเครื่องตรวจจับภาพ เราได้รวบรวมภาพ cryoEM และแก้ไขโครงสร้างของแฟลเจลลาร์ฟิลาเมนต์ที่ความละเอียดประมาณ 4 Å การพับโซ่หลักและโซ่ด้านข้างขนาดใหญ่จำนวนมากมองเห็นได้ชัดเจนเป็นครั้งแรกโดยการวิเคราะห์ภาพ cryoEM ของชีวโมเลกุล และสิ่งนี้ทำให้เราสร้างแบบจำลองอะตอมที่สมบูรณ์ของการประกอบโปรตีนขนาดใหญ่นี้
กล้อง CCD และตัวกรองพลังงานชนิด Ω
Graduate School of Frontier Biosciences ก่อตั้งขึ้นในมหาวิทยาลัยโอซาก้าในปี 2002 และเราย้ายห้องปฏิบัติการของเราไปที่อาคารนาโนชีววิทยาในปี 2004 ก่อนหน้านั้น เราได้รับเงินทุนจากรัฐบาลจาก MEXT ซึ่งเป็นส่วนหนึ่งของงบประมาณเสริม และขอให้ JEOL แนะนำ อุปกรณ์ที่พัฒนาขึ้นใหม่สองสามตัวสำหรับ cryoTEM พร้อมสเตจตัวอย่างที่ระบายความร้อนด้วยฮีเลียมเหลว นี่คือ JEM-3200FSC (รูปที่ 2) และเป็นรุ่นปรับปรุงของ cryoTEM (G4) รุ่นที่สี่ของฟูจิโยชิ [1] ที่ได้รับการแนะนำให้รู้จักกับ Riken Harima Research Institute ที่ไซต์ SPring-8 หนึ่งในอุปกรณ์ใหม่คือรุ่นปรับปรุงของตัวกรองพลังงานประเภท Ω ในคอลัมน์ และสิ่งนี้ถูกนำมาใช้เพื่อปรับปรุงอัตราส่วนสัญญาณต่อสัญญาณรบกวน (S/N) ของภาพ cryoEM โดยการกำจัดอิเล็กตรอนที่กระจัดกระจายอย่างไม่ยืดหยุ่นส่วนใหญ่ ซึ่งสูญเสียไป ความสอดคล้องกันอันเนื่องมาจากการสูญเสียพลังงาน ดังนั้นจึงมีส่วนทำให้เกิดสัญญาณรบกวนพื้นหลังที่สูงเท่านั้น และไม่ส่งผลต่อภาพ EM ที่มีความละเอียดสูง เราพบว่า S/N ของภาพดีขึ้นเกือบสองเท่าโดยตัวกรองพลังงานนี้ [7] อีกอุปกรณ์หนึ่งคือเครื่องตรวจจับภาพ CCD 4K × 4K (TVIPS F415MP) ซึ่งใช้สำหรับการบันทึกการเลี้ยวเบนของอิเล็กตรอนแล้ว แต่ไม่ได้ใช้สำหรับการถ่ายภาพเนื่องจากมีกำลังการแยกภาพต่ำกว่าฟิล์มถ่ายภาพ กำลังการแยกย่อยของมันต่ำกว่าเนื่องจากอิเล็กตรอนแต่ละตัวที่สร้างภาพ EM จะต้องถูกแปลงเป็นโฟตอนโดยใช้ชั้นบาง ๆ ของเรืองแสงวาบที่ด้านบนของบล็อกคัปปลิ้งใยแก้ว และภาพของอิเล็กตรอนแต่ละตัวจะเบลอเพราะการกระเจิงของอิเล็กตรอนภายในตัวเรืองแสงวาบ แม้จะมีข้อเสียนี้ CCD ก็ปรับปรุงประสิทธิภาพและปริมาณงานของการรวบรวมข้อมูลภาพคุณภาพสูงอย่างเห็นได้ชัด เนื่องจากเราสามารถเห็นภาพ EM และการแปลงฟูริเยร์ทันทีหลังจากการเปิดรับแสง ซึ่งช่วยให้เราสามารถตัดสินอย่างรวดเร็วและเชื่อถือได้เกี่ยวกับคุณภาพและ ความละเอียดของภาพ cryoEM แต่ละรายการในระหว่างการรวบรวมข้อมูล [7] นอกจากนี้เรายังสามารถปรับปรุงประสิทธิภาพของการเก็บรวบรวมข้อมูลภาพคุณภาพสูงได้อย่างมากด้วยการเพิ่มอุณหภูมิของชิ้นงานทดสอบจาก 4 K เป็นประมาณ 50 K โดยหยุดการจ่ายฮีเลียมเหลวจากถังในคอลัมน์ไปยังพ็อดตัวอย่างที่อยู่ด้านบนสุด แม้ว่าความเสียหายจากรังสีจะลดลงที่ 4 K แต่ภาพ cryoEM ส่วนใหญ่ได้รับความเดือดร้อนจากการเบลอของภาพที่มีอคติตามทิศทางในพื้นที่ อันเนื่องมาจากประจุที่เพิ่มขึ้นจากการฉายรังสีของลำแสงอิเล็กตรอนเนื่องจากค่าการนำไฟฟ้าที่ต่ำมากของฟิล์มน้ำแข็งบางที่ค่าต่ำสุด อุณหภูมิ. มีรูปภาพที่รวบรวมไว้น้อยกว่าสองสามภาพที่สามารถใช้ในการวิเคราะห์ภาพได้ เราแก้ไขปัญหาที่ยากลำบากนี้โดยการเพิ่มอุณหภูมิของชิ้นงานทดสอบเป็นประมาณ 50 K และภาพที่รวบรวมได้เกือบทั้งหมดมีคุณภาพสูงเพียงพอที่จะใช้ในการวิเคราะห์ภาพ [7]
การปรับปรุงและความก้าวหน้าทางเทคโนโลยีเหล่านี้ทำให้โครงการหลายปีก่อนหน้านี้แล้วเสร็จภายในสองสามสัปดาห์ตั้งแต่การรวบรวมข้อมูลไปจนถึงการสร้างภาพ 3 มิติ และช่วยให้เราสามารถแก้ไขโครงสร้างของส่วนประกอบทางชีวโมเลกุลที่แตกต่างกันและน่าสนใจได้ เช่น เบ็ดแฟลกเจลลาร์จากแบคทีเรีย เส้นใยแอคตินของกล้ามเนื้อ ฟิลาเมนต์ ParM ที่แยกพลาสมิดสำหรับการแบ่งเซลล์แบคทีเรีย หลอดเข็มบางของระบบการหลั่งของแบคทีเรียก่อโรคชนิดที่ 5 ที่มีความรุนแรง และแอคโตไมโอซิน rigor complex ทั้งหมดที่ความละเอียด 7 - 3 Å เราสามารถสร้างแบบจำลองอะตอมที่เชื่อถือได้เพื่อรับข้อมูลเชิงลึกเกี่ยวกับกลไกการทำงานของพวกมันโดยเชื่อมต่อและปรับแต่งโครงสร้างคริสตัลที่มีอยู่กับแผนที่ 7 มิติ [12-3.8] โครงสร้างของดิสก์แบบเรียงซ้อนที่เกิดจากโปรตีนเคลือบไวรัสโมเสกยาสูบได้รับการแก้ไขที่ความละเอียด XNUMX Å และภายในสองสามสัปดาห์เพื่อให้มองเห็นสายด้านข้างจำนวนมาก (Takashi Fujii, ไม่ได้เผยแพร่)
เวทีระบายความร้อนด้วยฮีเลียมเหลวด้านข้าง
ขั้นตัวอย่างที่ระบายความร้อนด้วยฮีเลียมเหลวซึ่งพัฒนาโดย Fujiyoshi ในปี 1980 เป็นประเภทรายการอันดับต้นๆ มีความเสถียรทางกลไกมาก แต่ไม่สามารถทำได้ด้วยอิเล็กตรอน cryotomography เนื่องจากเวทีไม่มีกลไกการเอียง สิ่งประดิษฐ์พิเศษถูกสร้างขึ้นสำหรับการถ่ายภาพคริสตัล 2 มิติในมุมเอียงต่างๆ มากมาย เพื่อให้ครอบคลุมพื้นที่ 3D Fourier ส่วนใหญ่สำหรับการสร้างภาพ 3 มิติที่มีความละเอียดสูง แต่ก็ยังใช้เวลานาน ดังนั้น ฟูจิโยชิจึงตัดสินใจออกแบบขั้นตอนแรกสุดของเขาใหม่เพื่อใช้กลไกการเอียงและใช้สำหรับงบประมาณ MEXT ที่เรียกว่ากองทุนประสานงานพิเศษเพื่อส่งเสริมวิทยาศาสตร์และเทคโนโลยีเพื่อการพัฒนาโดย JEOL และฉันได้เข้าร่วมโครงการนี้ในฐานะผู้เสนอร่วม การพัฒนาในโครงการนี้คือ cryoTEM ของ Generation 6 (G6) (G2) (รูปที่ 2006) JEOL สร้างอาคารสองแห่งและส่งมอบให้กับมหาวิทยาลัยเกียวโตและมหาวิทยาลัยโอซาก้าในปี 1 [3] หนึ่งในหัวข้อการวิจัยหลักของเราคือ flagellar motor ของแบคทีเรีย ซึ่งหมุนเส้นใย flagellar ที่ขดลวดซุปเปอร์คอยล์เป็นใบพัดเกลียวเพื่อสร้างแรงผลักดันสำหรับการเคลื่อนไหวของแบคทีเรียในการว่ายน้ำ เราต้องการข้อมูลโครงสร้างโดยละเอียดของฐานแฟลเจลลาร์ซึ่งขยายเยื่อหุ้มเซลล์เพื่อให้เข้าใจกลไกการหมุนของมอเตอร์ แต่ส่วนประกอบที่สำคัญของมอเตอร์ เช่น สเตเตอร์ยูนิต จะแยกออกจากตัวเบสในระหว่างการแยกและทำให้บริสุทธิ์ด้วยการละลายของสารซักฟอก เนื่องจากการยึดเกาะที่อ่อนแอ ดังนั้นโครงสร้างของมอเตอร์ flagellar จึงไม่สามารถสังเกตได้ในสถานะการทำงานของมันเมื่อแยกออกจากเซลล์ สิ่งที่เราตั้งใจจะทำกับ cryoTEM ใหม่นี้คือการสร้างวิธีการของอิเล็กตรอน cryotomography (ECT) เพื่อสังเกตโครงสร้างในแหล่งกำเนิดของสารเชิงซ้อนทางชีวโมเลกุลภายในเซลล์ เราพยายามสร้างวิธี ECT ด้วย cryoTEM ใหม่นี้ซึ่งมีกลไกการเอียงเพื่อให้เห็นภาพโครงสร้างมอเตอร์ที่ใช้งานได้ในเยื่อหุ้มเซลล์โดยการแช่แข็งเซลล์แบคทีเรียทั้งหมดบนตารางตัวอย่างอย่างรวดเร็ว และบันทึกภาพเอียงจำนวนมากเพื่อสร้างภาพ 1 มิติของเซลล์ขึ้นใหม่ ด้วยตัวฐานflagellar อย่างไรก็ตาม เนื่องจากเส้นผ่านศูนย์กลางของเซลล์ซัลโมเนลลามีความหนาเกือบ 60 ไมโครเมตร และความหนาของชิ้นงานทดสอบสำหรับลำอิเล็กตรอนที่จะผ่านจะหนาขึ้นสองเท่าที่มุมเอียง 300º ซึ่งหนาเกินไปสำหรับอิเล็กตรอน 13 keV ที่จะผ่านและกระจายอย่างยืดหยุ่นเพื่อสร้าง EM ภาพที่มีคุณภาพดีต้องรอหลายปีกว่าจะได้เห็นภาพโครงสร้าง in situ ของ basal body จนได้แนะนำเทคนิคทางพันธุวิศวกรรมในการผลิต “mini-cell” เพื่อให้เซลล์ Salmonella มีขนาดเล็กกว่าชนิดพันธุ์ธรรมชาติมาก [XNUMX] ].
เพื่อปรับปรุงประสิทธิภาพและปริมาณงานของการรวบรวมข้อมูลภาพสำหรับการวิเคราะห์ภาพที่มีอนุภาคเดียว เราตัดสินใจในปี 2011 ที่จะเปลี่ยนขั้นตอนของตัวอย่างเป็นประเภททางเข้าด้านข้างของการออกแบบดั้งเดิมของ JEOL ที่มีศักยภาพในการรวบรวมข้อมูลอัตโนมัติโดยการควบคุมด้วยคอมพิวเตอร์ . cryoTEM รุ่นดัดแปลงนี้คือ G6N (รุ่นที่ 6 พร้อมการปรับเปลี่ยนใหม่) (รูปที่ 2)
การนำชิ้นงานทดสอบนี้ร่วมกับชิ้นส่วนขั้วเลนส์ใกล้วัตถุประเภทต่างๆ ส่งผลให้การใช้งานและความละเอียดของภาพดีขึ้นเหนือความคาดหมายของเรา วิธีมาตรฐานวิธีหนึ่งในการตรวจสอบความละเอียดของภาพสูงสุดที่เป็นไปได้ของ cryoTEM คือการถ่ายภาพ EM ของชิ้นงานทดสอบ เช่น ฟิล์มบางอัลลอยด์แพลตตินัม-อิริเดียม (Pt/Ir) ที่ไม่มีรูปร่าง ภายใต้สภาวะพร่ามัวที่ค่อนข้างใหญ่ประมาณ 1 µm แล้วดูที่การแปลงฟูริเยร์เพื่อดูว่าวงแหวน Thon ยาวแค่ไหน (ดูรูปที่ 4) นี่คือสิ่งที่เราทำเป็นประจำเพื่อตรวจสอบความละเอียดของภาพ cryoEM ของชิ้นงานที่ฝังด้วยน้ำแข็งไฮเดรตที่แช่เยือกแข็ง และความพร่ามัวขนาดใหญ่เช่นนี้จำเป็นต่อการเพิ่มคอนทราสต์ของภาพที่ความละเอียดต่ำเพื่อให้มองเห็นชีวโมเลกุลที่ฝังในน้ำแข็งสำหรับการวิเคราะห์ภาพ ด้วยการใช้ฟิล์มอัลลอยด์แบบบาง เราไม่ได้ถูกจำกัดด้วยปริมาณอิเล็กตรอนต่ำที่เราต้องใช้เพื่อหลีกเลี่ยงความเสียหายจากรังสีเพื่อดูสัญญาณวงแหวนทอนที่อ่อนแอที่ความละเอียดสูงสุดเท่าที่เป็นไปได้ จากการทดสอบความละเอียดของภาพที่ดำเนินการในวันที่ติดตั้งเสร็จสิ้นของ cryoTEM G6N เราจึงเห็นวงแหวน Thon ที่ขยายเกินความละเอียด 2.0 Å ในการทำให้วงแหวน Thon ขยายไปถึงความละเอียดสูงสุดที่เป็นไปได้ภายใต้สภาวะพร่ามัวดังกล่าว ต้องตั้งค่าระบบออปติคัลอิเล็กตรอนของ cryoTEM เพื่อสร้างลำแสงส่องสว่างคู่ขนานบนชิ้นงานทดสอบ โชคดีที่ชิ้นส่วนขั้วเลนส์ใกล้วัตถุของ cryoTEM นี้ได้รับการออกแบบมาเพื่อตอบสนองความต้องการดังกล่าวภายใต้สภาวะการถ่ายภาพแทบใดๆ ที่ผู้ใช้ตั้งค่าเพื่อรวบรวมภาพแม้จะไม่ได้สติถึงสภาวะแสงคู่ขนาน
อย่างไรก็ตาม ยังมีปัญหาอื่นๆ แม้ว่าระยะของชิ้นงานทดสอบจะระบายความร้อนด้วยฮีเลียมเหลว แต่อุณหภูมิของชิ้นงานทดสอบก็สูงกว่าอุณหภูมิของชิ้นงานทดสอบประเภท G4 เล็กน้อย และอุณหภูมิไม่สามารถเพิ่มเป็น 50 K ได้เหมือนกับที่เราทำกับประเภทรายการบนสุดของ G4 นอกจากนี้ อุปทานฮีเลียมยังมีจำกัดทั่วโลกและราคาก็สูงขึ้น สิ่งอำนวยความสะดวกด้วยกล้องจุลทรรศน์ของเราเชื่อมต่อกับท่อนำฮีเลียมกู้คืนไปยังศูนย์อุณหภูมิต่ำของมหาวิทยาลัยโอซาก้าในวิทยาเขตเดียวกัน แต่สายการกู้ฮีเลียมของเรามักทำให้เกิดปัญหากับการทำงานของศูนย์อุณหภูมิต่ำโดยการปนเปื้อนในอากาศ เราจึงตัดสินใจหยุดใช้ฮีเลียมเหลวประมาณปี 2012 เราเติมไนโตรเจนเหลวลงในถังไนโตรเจนเหลวและถังฮีเลียมเหลวของ cryoTEM G6N และพบว่าอุณหภูมิของชิ้นงานทดสอบสามารถรักษาให้คงที่ที่ 77 K ได้อย่างแม่นยำที่อุณหภูมิไนโตรเจนเหลว เป็นเวลา 7-8 ชั่วโมง ด้วยการใช้ซอฟต์แวร์ควบคุมกล้อง CCD อย่างเต็มที่โดย TVIPS การเก็บข้อมูลอัตโนมัติเกือบจะเป็นไปได้ และทำให้การเก็บรวบรวมข้อมูลภาพ cryoEM มีประสิทธิภาพมาก
รูปที่ 4 วงแหวน Thon ของภาพฟิล์มบาง Pt/Ir ที่บันทึกด้วย CRYO ARM™ ต้นแบบ
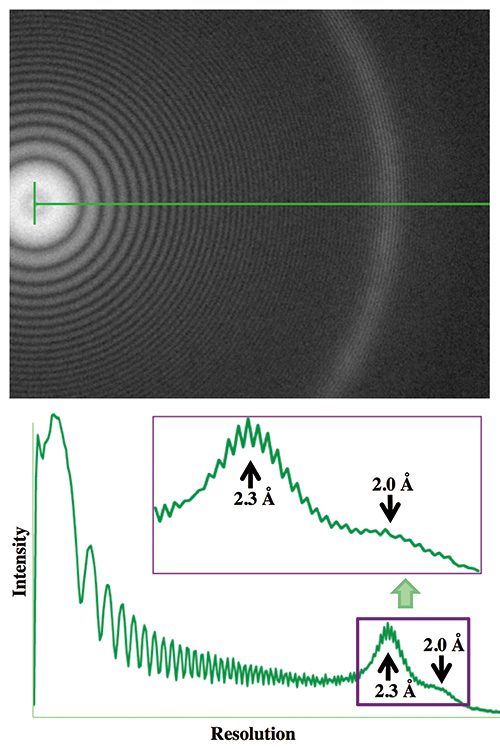
ภาพ cryoEM ของฟิล์มบาง Pt/Ir ถ่ายภายใต้ความพร่ามัว 1 µm โดยใช้ CRYO ARM™ ต้นแบบที่ทำงานที่ 200 kV วงแหวน Thon ในการแปลงฟูริเยร์ขยายเป็นความละเอียด 1.8 Å
กล้องตรวจจับอิเล็กตรอนแบบตรงแบบ CMOS
และในที่สุด ช่วงเวลาที่สดใสของสนาม cryoEM ก็มาถึงในปี 2013 โดยการมาถึงของกล้องตรวจจับอิเล็กตรอนแบบใช้ CMOS โดยตรง David Agard และเพื่อนร่วมงานของเขาที่มหาวิทยาลัยแคลิฟอร์เนีย ซานฟรานซิสโก ได้พัฒนาเครื่องตรวจจับภาพ EM ร่วมกับ Gatan ซึ่งเป็นหนึ่งในผู้ผลิตกล้อง EM รายใหญ่ โดยการนำอุปกรณ์ CMOS มาใช้ใหม่สำหรับเครื่องตรวจจับภาพเอ็กซ์เรย์ที่พัฒนาโดยกลุ่มที่ มหาวิทยาลัยแคลิฟอร์เนีย เบิร์กลีย์ Gatan เสร็จสิ้นการพัฒนาระบบกล้องนี้และวางจำหน่ายในเชิงพาณิชย์ในปี 2013 ในชื่อ K2 Summit ชิปภาพ CMOS มีคุณสมบัติเฉพาะที่ยอดเยี่ยม โดยมีพิกเซล 4K x 4K ทนทานต่อการฉายรังสีโดยตรงของอิเล็กตรอนพลังงานสูงที่เร่งความเร็วเป็น 300 keV หรือสูงกว่านั้น และแสดงภาพเบลอน้อยที่สุดเนื่องจากการกระเจิงของอิเล็กตรอนภายในเซมิคอนดักเตอร์ตรวจจับอิเล็กตรอนที่บางมาก เลเยอร์ และเหนือสิ่งอื่นใด อัตราการรับข้อมูลของภาพ 16 ล้านพิกเซลคือ 400 เฟรมต่อวินาที ซึ่งทำให้สามารถนับอิเล็กตรอนเดี่ยวได้ เนื่องจากปริมาณอิเล็กตรอนทั้งหมดที่ใช้สำหรับการบันทึกภาพ cryoEM คือ 20 ถึง 30 e-/Å ในการเปิดรับแสงหนึ่งวินาที จำนวนอิเล็กตรอนที่เข้ามาในระนาบของเครื่องตรวจจับต่อแต่ละเฟรมจะถูกจำกัดและนับได้ หากอัตราปริมาณรังสีลดลงประมาณ 10 เท่าโดยทำให้เวลาเปิดรับแสงนานขึ้น 10 เท่า การนับอิเลคตรอนเดี่ยวทำให้เราได้เปรียบอย่างมากในการลดระดับสัญญาณรบกวนของภาพ แหล่งที่มาของสัญญาณรบกวนที่สำคัญอย่างหนึ่งในการบันทึกภาพ cryoEM คือสัญญาณรบกวนทางสถิติซึ่งมีขนาดใหญ่เมื่อเทียบกับสัญญาณ เนื่องจากจำนวนอิเล็กตรอนที่สร้างภาพ cryoEM แต่ละรายการมีน้อยเนื่องจากการถ่ายภาพในขนาดต่ำเพื่อหลีกเลี่ยงความเสียหายจากรังสี ไม่มีทางหนีจากมันได้ อย่างไรก็ตาม การนับอิเล็กตรอนแบบเดี่ยวสามารถลดสัญญาณรบกวนของ Landau ซึ่งเป็นสัญญาณรบกวนภายในตัวของเครื่องตรวจจับที่เกิดจากการกระจายขนาดใหญ่ในแอมพลิจูดของสัญญาณที่เครื่องตรวจจับภาพที่สะสมพลังงานทุกประเภท เช่น CCD สร้างขึ้นสำหรับการตรวจจับอิเล็กตรอนแต่ละตัว
Yifan Cheng แห่งมหาวิทยาลัยแคลิฟอร์เนีย ซานฟรานซิสโกใช้ประโยชน์จากประสิทธิภาพของระบบกล้อง CMOS นี้ให้เกิดประโยชน์สูงสุด และได้คิดค้นวิธีการรวบรวมภาพโปรตีน cryoEM คุณภาพสูงที่คมชัดด้วยการถ่ายภาพในโหมดภาพยนตร์และการแก้ไขการเคลื่อนไหว เขาและเพื่อนร่วมงานประสบความสำเร็จในการวิเคราะห์โครงสร้าง 3 มิติของโปรตีนเมมเบรน ซึ่งเป็นช่องไอออนของตัวรับ TRPV1 ซึ่งรับรู้ความร้อนและความเผ็ดร้อนจากตัวอย่างสารละลายจำนวนเล็กน้อยที่หลบเลี่ยงการตกผลึกตลอดหลายปีที่ผ่านมา ทั้งๆ ที่กลุ่มเพื่อนร่วมงานของเขาใช้ความพยายามอย่างมาก และตีพิมพ์บทความสองฉบับใน Nature เมื่อสิ้นปี 2013 [14, 15] โครงสร้างได้รับการแก้ไขที่ความละเอียด 3.4 Å โดยการวิเคราะห์ภาพอนุภาคเดี่ยวประมาณ 100,000, 1,000 ภาพของโปรตีนที่หยิบมาจากภาพ cryoEM ประมาณ 80 ภาพที่ได้จากสารละลายตัวอย่างจำนวนเล็กน้อยที่มีโปรตีนที่ละลายในผงซักฟอก หลังจากการประมวลผลแต่ละเฟรมสำหรับการนับอิเล็กตรอนเดี่ยว พวกเขาได้เพิ่มทุกๆ 5 เฟรมเพื่อสร้างภาพยนตร์ cryoEM ที่ 16 เฟรม/วินาที จากนั้นจึงเพิ่มเฟรมภาพยนตร์เหล่านี้ด้วยการแก้ไขการเคลื่อนไหวเพื่อลดการเบลอของภาพที่เกิดจากการเลื่อนของขั้นตอนตัวอย่างและ การบิดเบี้ยวของฟิล์มน้ำแข็งที่เกิดจากการฉายรังสีอิเล็กตรอนเพื่อทำให้ภาพ cryoEM สุดท้ายมีความคมชัดมาก [XNUMX]
เราสามารถแนะนำ Gatan K2 Summit ให้กับ cryoTEM G6N ของเราได้ (รูปที่ 2) ในปี 2015 และพยายามใช้ประสิทธิภาพสูงเป็นเครื่องตรวจจับภาพ การบันทึกภาพในโหมดภาพยนตร์ทำให้เราสามารถจับภาพโครงสร้างของสารชีวโมเลกุลต่างๆ รวมทั้งโปรตีนเมมเบรนที่ความละเอียดใกล้อะตอม และความละเอียดสูงสุดที่เราได้รับคือ 2.7 Å สำหรับโครงสร้างของท่อเข็มแบบบางของระบบคัดหลั่ง Shigella type III virulence-factor (Takashi Fujii & Yurika Yamada, ไม่ได้เผยแพร่). เนื่องจากความละเอียดที่ทำได้ขึ้นอยู่กับความเสถียรของโครงสร้างของโมเลกุลตัวอย่างและความหนาของฟิล์มน้ำแข็งบาง ๆ บนกริดไครโออีเอ็มเป็นส่วนใหญ่ ดังนั้นจึงควรมีความละเอียดที่เกิน 2.0 Å ด้วยตัวอย่างและกริดที่ดีกว่า
การพัฒนา CRYO ARM™
บริษัท FEI (Thermo Fisher Scientific ตั้งแต่ปี 2017) หนึ่งในผู้ผลิตกล้องจุลทรรศน์อิเล็กตรอนรายใหญ่ เริ่มพัฒนา cryoTEM ที่เป็นมิตรกับผู้ใช้ประสิทธิภาพสูงสำหรับนักวิจัยด้านวิทยาศาสตร์เพื่อชีวิตในช่วงปลายทศวรรษ 1990 และผลิต cryoTEM ชื่อ Polara ในปี 2004 และ Titan Krios ในปี 2008 Titan Krios เป็นระบบที่ใช้งานง่ายเป็นพิเศษ โดยสามารถจัดเก็บกริด cryoEM ได้ 12 กริดในนิตยสาร ทำให้ผู้ใช้สามารถโหลดแต่ละกริดไปยังสเตจของชิ้นงานทดสอบที่ระบายความร้อนด้วยไนโตรเจนเหลวได้ถึงประมาณ 90 K โดยอุปกรณ์โหลดอัตโนมัติ (ตัวโหลดอัตโนมัติ) และอนุญาตให้รวบรวมข้อมูลภาพอัตโนมัติโดยระบุพื้นที่สำหรับการบันทึกภาพหลังจากที่ผู้ใช้ตัดสินคุณภาพของตารางแล้ว Titan Krios ได้รับการประเมินอย่างสูงจากผู้ใช้จำนวนมากในด้าน cryoEM ทั่วโลก เนื่องจากมีประสิทธิภาพสูงในการบรรลุความละเอียดสูงและใช้งานง่าย ทั้งในการสังเกตโครงสร้างเซลล์แบบ 3 มิติโดย ECT และการวิเคราะห์ภาพอนุภาคเดี่ยว เนื่องจากเทคนิคทั้งสองต้องใช้ cryoEM จำนวนมาก ข้อมูลภาพที่จะเก็บรวบรวม
JEOL ได้พัฒนา JEM-ARM200F (ARM: Atomic Resolution Microscope) ในปี 2009 ให้เป็น TEM ที่มีความละเอียดสูงสำหรับการวิจัยวัสดุ และได้รับการประเมินที่สูงที่สุดในโลก ดังนั้นเราจึงคิดว่า JEOL ควรพัฒนา cryoTEM แบบ ARM โดยใช้เลนส์อิเล็กตรอนที่มีความละเอียดสูงเป็นพิเศษโดยการพัฒนาอุปกรณ์ที่จำเป็น เช่น ขั้นตัวอย่างที่ระบายความร้อนด้วยไนโตรเจนเหลวที่ควบคุมด้วยคอมพิวเตอร์ที่มีความเสถียรสูง ซึ่งสามารถเพิ่มประสิทธิภาพการทำงานของเลนส์อิเล็กตรอนความละเอียดสูงได้สูงสุด , เครื่องโหลดอัตโนมัติแบบกริด cryoEM ที่ใช้งานง่ายและสะดวกกว่าของ Titan Krios และระบบเติมไนโตรเจนเหลวอัตโนมัติอัตโนมัติ และยังเพิ่มตัวกรองพลังงานในคอลัมน์ประเภท Ω เพื่อลดอิเล็กตรอนที่กระจัดกระจายอย่างไม่ยืดหยุ่นให้เหลือน้อยที่สุด เพิ่ม S/N ของภาพที่บันทึก ตัวกรอง Ω ยังมีประโยชน์สำหรับการวัดความหนาของฟิล์มน้ำแข็งอย่างรวดเร็วสำหรับการประเมินและตัดสินคุณภาพของกริด EM ในเวลาที่เหมาะสม JSPS ได้ประกาศเงินทุนจำนวนมากที่ชื่อว่า State-of-Art Research Infrastructure Establishment Program และข้อเสนอและการสมัครขอรับทุนโดย Toshio Yanagida ในฐานะผู้อำนวยการ Riken Quantitative Biology Center (QBiC) (เช่น ได้รับการแต่งตั้งเป็นพิเศษ ศาสตราจารย์และศาสตราจารย์กิตติคุณจากมหาวิทยาลัยโอซาก้า ผู้อำนวยการศูนย์ข้อมูลและโครงข่ายประสาทเทียม) ได้รับการอนุมัติในปี 2010 เพื่อเตรียมพร้อมสำหรับการจัดตั้ง Riken QBiC งบประมาณนี้จัดสรรให้กับ Riken และ Osaka University สำหรับกิจกรรมการวิจัยร่วมกัน เราเสนอให้ใช้งบประมาณส่วนหนึ่งในการพัฒนา cryoTEM ความละเอียดสูงที่ใช้งานง่าย และได้รับการอนุมัติให้ขอให้ JEOL พัฒนา เราถ่ายทอดความคิด วิสัยทัศน์ และข้อกำหนดเฉพาะของเราไปยังทีมเทคนิคของ JEOL และพวกเขาตกลงที่จะเริ่มการพัฒนา JEOL วางแผนที่จะสร้างต้นแบบ cryoTEM ให้เสร็จภายในฤดูใบไม้ผลิปี 2014 และเราได้พูดคุยกันหลายครั้งหลายครั้งในการประชุมหลายครั้ง ชื่อเล่นที่เราตั้งขึ้นมาสำหรับ cryoTEM ใหม่นี้คือ CryoARM และ JEOL ตั้งชื่อว่า CRYO ARM™ (รูปที่ 2) หนึ่งในเป้าหมายที่เราตั้งไว้คือเกิน 2.0 Å เนื่องจากความละเอียดที่ทำได้ในการวิเคราะห์โครงสร้างของสารเชิงซ้อนทางชีวโมเลกุล
แม้ว่าการพัฒนาจะล่าช้าเนื่องจากสถานการณ์และเหตุผลต่างๆ แต่ในที่สุดก็มีการติดตั้งต้นแบบ cryoTEM ในเดือนพฤษภาคม 2016 ในอาคารนาโนชีววิทยา ตามแผนการออกแบบเริ่มต้นในขณะที่ยังไม่มี Cold FEG ต้นแบบ CRYO ARM นี้ได้รับการติดตั้งด้วย Thermal FEG ที่มีแรงดันไฟฟ้าเร่ง 200 kV เราตรวจสอบวงแหวน Thon ในการแปลงฟูริเยร์ของภาพฟิล์มบาง Pt/Ir ที่บันทึกภายใต้ความพร่ามัว 1 µm และยืนยันว่าวงแหวน Thon ขยายเกินความละเอียด 1.8 Å (รูปที่ 4) ภารกิจสำคัญของเราเริ่มต้นจากจุดนี้ เราได้เตรียมกริด cryoEM ของตัวอย่างชีวโมเลกุลต่างๆ มากมาย และรวบรวมภาพ cryoEM เพื่อวิเคราะห์โครงสร้างโดยการวิเคราะห์ภาพอนุภาคเดี่ยวเพื่อประเมินประสิทธิภาพของ cryoTEM สำหรับความละเอียด นอกจากนี้เรายังตรวจสอบและประเมินแง่มุมต่างๆ ของ cryoTEM อย่างรอบคอบ เช่น ความเป็นมิตรต่อผู้ใช้ของการทำงานของ cryoTEM และการควบคุมซอฟต์แวร์ ความรวดเร็วและความราบรื่นของการทำงานแบบแมนนวลด้วย cryo-เวิร์กสเตชันสำหรับการถ่ายโอนกริด cryoEM รวมถึงการทำงานของตัวโหลดอัตโนมัติ ประสิทธิภาพของ การเก็บรวบรวมข้อมูลโดยการบันทึกภาพอัตโนมัติ และจุดที่ต้องปรับปรุงในซอฟต์แวร์รับข้อมูลอัตโนมัติ JADAS ไปสู่การเก็บรวบรวมข้อมูลแบบอัตโนมัติทั้งหมด เพื่อป้อนกลับไปยังวิศวกรของ JEOL ตามที่เราคาดการณ์ไว้ ปัญหาทางกลจำนวนมากมักเกิดขึ้นกับตัวโหลดอัตโนมัติและเวิร์กสเตชันแบบแช่แข็ง และวิศวกรของ JEOL ต้องออกแบบระบบและชิ้นส่วนใหม่ ซึ่งบางครั้งก็มีวัสดุใหม่ และนำมาจากอากิชิมะ โตเกียว เพื่อแทนที่ด้วยของเก่า และทำการปรับเซ็นเซอร์และแอคทูเอเตอร์เพื่อแก้ไขปัญหาเหล่านั้น เกือบครึ่งปีหลังการติดตั้ง ขั้นตอนของชิ้นงานทดสอบได้รับการออกแบบใหม่เป็นส่วนใหญ่เพื่อความเสถียรที่สูงขึ้น และซอฟต์แวร์ควบคุมระบบ TEM ยังได้รับการปรับปรุง รวมถึงการแนะนำปุ่มเพียงคลิกเดียวบนจอแสดงผลเพื่อให้ได้แสงแบบคู่ขนานและการจัดตำแหน่งเลนส์ที่ปราศจากอาการโคม่า วิธีการ cryoEM มีความรู้มากมายที่สั่งสมมาเป็นเวลานานหลายปีของการพัฒนา และระบบ cryoTEM สามารถทำงานได้ดีโดยการใช้และตระหนักถึงความรู้ความชำนาญและข้อกำหนดที่จำเป็นทั้งหมดเท่านั้น วิศวกรของ JEOL ทำงานอย่างหนักเพื่อให้ระบบ cryoTEM นี้ทำงานได้ตามที่เราต้องการ มันคือเดือนกุมภาพันธ์ 2017 เมื่อทุกฟังก์ชันของต้นแบบ CRYO ARM™ ต้นแบบนี้เริ่มทำงานอย่างเสถียร และเราไม่เคยมีปัญหาร้ายแรงใดๆ เลยตั้งแต่นั้นมา
เราใช้β-galactosidase เป็นตัวอย่างทดสอบเพื่อดูความละเอียดที่สามารถเข้าถึงได้ของการวิเคราะห์โครงสร้างด้วยข้อมูลภาพที่รวบรวมด้วย CRYO ARM™ นอกจากนี้ เรายังประเมินความเสถียรในการทำงานของฮาร์ดแวร์และซอฟต์แวร์ต่อไปเพื่อปรับปรุงเพิ่มเติม และเน้นเป็นพิเศษที่ JADAS ซึ่งเป็นโปรแกรมซอฟต์แวร์เก็บข้อมูลอัตโนมัติที่ JEOL พัฒนามาตลอดหลายปีที่ผ่านมา เพื่อทำให้เป็นสิ่งที่ผู้ใช้ cryoEM ทุกคนสามารถใช้งานได้อย่างสะดวกสบาย การรวบรวมข้อมูลที่มีประสิทธิภาพ JADAS ใช้งานได้จริงหลังจากการอัปเดตหลายครั้ง และในฤดูร้อนปี 2017 เราสามารถรวบรวมรูปภาพ 2,500 รูปจากตาราง cryoEM ของβ-galactosidase ในเวลา 3 วัน เรารวบรวมภาพอนุภาคเดี่ยวประมาณ 350,000 ภาพ จากนั้นเลือกภาพที่ดีประมาณ 88,000 ภาพโดยผ่านการจำแนกประเภท 2D และ 3D โดย
คุณเป็นผู้เชี่ยวชาญทางการแพทย์หรือบุคลากรที่เกี่ยวข้องกับการรักษาพยาบาลหรือไม่?
ไม่
โปรดทราบว่าหน้าเหล่านี้ไม่ได้มีวัตถุประสงค์เพื่อให้ข้อมูลเกี่ยวกับผลิตภัณฑ์แก่ประชาชนทั่วไป
